E27038 UMNファーマ 有価証券報告書 第10期 (2013/12期)
| 【表紙】 | |
|---|---|
| 【提出書類】 | 有価証券報告書 |
| 【根拠条文】 | 金融商品取引法第24条第1項 |
| 【提出先】 | 関東財務局長 |
| 【提出日】 | 平成26年3月31日 |
| 【事業年度】 | 第10期(自 平成25年1月1日 至 平成25年12月31日) |
| 【会社名】 | 株式会社UMNファーマ |
| 【英訳名】 | UMN Pharma Inc. |
| 【代表者の役職氏名】 | 代表取締役会長兼社長 平野 達義 |
| 【本店の所在の場所】 | 秋田県秋田市御所野湯本四丁目2番3号 |
| 【電話番号】 | 018-892-7411(代表) |
| 【事務連絡者氏名】 | 取締役財務部長 橋本 裕之 |
| 【最寄りの連絡場所】 | 神奈川県横浜市西区みなとみらい二丁目2番1号 |
| 【電話番号】 | 045-263-9200(代表) |
| 【事務連絡者氏名】 | 取締役財務部長 橋本 裕之 |
| 【縦覧に供する場所】 | 株式会社東京証券取引所 (東京都中央区日本橋兜町2番1号) |
第一部 【企業情報】
Section titled “第一部 【企業情報】”第1 【企業の概況】
Section titled “第1 【企業の概況】”1 【主要な経営指標等の推移】
Section titled “1 【主要な経営指標等の推移】”(1) 連結経営指標等
Section titled “(1) 連結経営指標等”| 回次 | 第6期 | 第7期 | 第8期 | 第9期 | 第10期 | |
| 決算年月 | 平成21年12月 | 平成22年12月 | 平成23年12月 | 平成24年12月 | 平成25年12月 | |
| 売上高 | (千円) | ― | 2,000,000 | 1,000,000 | 108,225 | 93,379 |
| 経常利益又は経常損失(△) | (千円) | ― | 349,653 | △1,080,083 | △2,652,395 | △4,147,960 |
| 当期純利益又は当期純損失(△) | (千円) | ― | 383,397 | △477,744 | △1,996,917 | △3,717,117 |
| 包括利益 | (千円) | ― | ― | △730,048 | △2,645,290 | △4,227,410 |
| 純資産額 | (千円) | ― | 2,113,236 | 2,824,187 | 4,369,293 | 4,253,491 |
| 総資産額 | (千円) | ― | 5,436,962 | 3,812,603 | 14,031,644 | 19,001,793 |
| 1株当たり純資産額 | (円) | ― | 457.77 | 533.53 | 599.10 | 498.74 |
| 1株当たり当期純利益金額又は当期純損失金額(△) | (円) | ― | 94.62 | △106.87 | △420.61 | △491.59 |
| 潜在株式調整後1株当たり当期純利益金額 | (円) | ― | ― | ― | ― | ― |
| 自己資本比率 | (%) | ― | 35.9 | 63.2 | 30.8 | 22.1 |
| 自己資本利益率 | (%) | ― | 19.7 | ― | ― | ― |
| 株価収益率 | (倍) | ― | ― | ― | ― | ― |
| 営業活動によるキャッシュ・フロー | (千円) | ― | 2,694,960 | △849,177 | △1,188,134 | △3,578,459 |
| 投資活動によるキャッシュ・フロー | (千円) | ― | △926,582 | △2,795,709 | △8,741,491 | △4,150,619 |
| 財務活動によるキャッシュ・フロー | (千円) | ― | 2,014,171 | 1,133,492 | 12,360,998 | 8,113,793 |
| 現金及び現金同等物の期末残高 | (千円) | ― | 3,962,965 | 1,451,570 | 3,882,943 | 4,267,657 |
| 従業員数〔ほか、平均臨時雇用人員〕 | (名) | ― | 30 | 53 | 89 | 91 |
| 〔-〕 | 〔3〕 | 〔1〕 | 〔3〕 | 〔-〕 | ||
(注) 1.当社は第7期より連結財務諸表を作成しております。
2.売上高には、消費税等は含まれておりません。
3.第7期の潜在株式調整後1株当たり当期純利益金額については、潜在株式は存在するものの、当社株式は非上場であり、期中平均株価が把握できないため、記載しておりません。
4.第8期、第9期及び第10期の潜在株式調整後1株当たり当期純利益金額は、潜在株式は存在するものの、1株当たり当期純損失金額を計上しているため、記載しておりません。
5.自己資本利益率は、第8期、第9期及び第10期は当期純損失を計上しているため、記載しておりません。
6.第7期及び第8期の株価収益率は、当社株式が非上場であるため、記載しておりません。
7.第9期及び第10期の株価収益率は、1株当たり当期純損失金額であるため、記載しておりません。
8.従業員数欄の「〔外書〕」は、臨時従業員数(派遣社員含む)の年間平均雇用人員であります。
9.第7期、第8期、第9期及び第10期の連結財務諸表については、金融商品取引法第193条の2第1項の規定に基づき、有限責任監査法人トーマツの監査を受けております。
10.第7期の自己資本利益率は、連結初年度のため、期末自己資本額に基づいて計算しております。
(2) 提出会社の経営指標等
Section titled “(2) 提出会社の経営指標等”| 回次 | 第6期 | 第7期 | 第8期 | 第9期 | 第10期 | |
| 決算年月 | 平成21年12月 | 平成22年12月 | 平成23年12月 | 平成24年12月 | 平成25年12月 | |
| 売上高 | (千円) | ― | 2,000,000 | 1,000,000 | 108,225 | 92,929 |
| 経常利益又は経常損失(△) | (千円) | △736,285 | 422,846 | △588,745 | △1,325,927 | △3,179,228 |
| 当期純利益又は当期純損失(△) | (千円) | △737,891 | 420,359 | △229,829 | △1,328,729 | △3,207,073 |
| 資本金 | (千円) | 2,073,700 | 2,734,650 | 3,206,400 | 5,152,348 | 6,956,361 |
| 発行済株式総数 | (株) | 75,057 | 85,232 | 4,516,600 | 7,205,200 | 8,425,900 |
| 純資産額 | (千円) | 245,533 | 1,987,792 | 2,694,606 | 5,269,705 | 5,671,638 |
| 総資産額 | (千円) | 521,859 | 5,310,089 | 3,659,468 | 6,079,255 | 7,493,207 |
| 1株当たり純資産額 | (円) | 65.43 | 466.44 | 596.60 | 731.38 | 672.38 |
| 1株当たり配当額(1株当たり中間配当額) | (円) | ― | ― | ― | ― | ― |
| (-) | (-) | (-) | (-) | (-) | ||
| 1株当たり当期純利益金額又は当期純損失金額(△) | (円) | △197.06 | 103.75 | △51.41 | △279.87 | △424.14 |
| 潜在株式調整後1株当たり当期純利益金額 | (円) | ― | ― | ― | ― | ― |
| 自己資本比率 | (%) | 47.0 | 37.4 | 73.6 | 86.7 | 75.6 |
| 自己資本利益率 | (%) | ― | 37.6 | ― | ― | ― |
| 株価収益率 | (倍) | ― | ― | ― | ― | ― |
| 配当性向 | (%) | ― | ― | ― | ― | ― |
| 従業員数〔ほか、平均臨時雇用人員〕 | (名) | 21 | 15 | 18 | 24 | 29 |
| 〔5〕 | 〔3〕 | 〔1〕 | 〔2〕 | 〔-〕 | ||
(注) 1.売上高には、消費税等は含まれておりません。
2.第6期、第8期、第9期及び第10期の潜在株式調整後1株当たり当期純利益金額は、潜在株式は存在するものの、1株当たり当期純損失金額を計上しているため記載しておりません。
3.第7期の潜在株式調整後1株当たり当期純利益金額は、潜在株式は存在するものの、当社株式は非上場であり、期中平均株価が把握できないため記載しておりません。
4.自己資本利益率は、第6期、第8期、第9期及び第10期は当期純損失を計上しているため、記載しておりません。
5.第6期、第7期及び第8期の株価収益率は、当社株式が非上場であるため、記載しておりません。
6.第9期及び第10期の株価収益率は、1株当たり当期純損失金額であるため、記載しておりません。
7.第7期、第8期、第9期及び第10期の財務諸表については、金融商品取引法第193条の2第1項の規定に基づき、有限責任監査法人トーマツにより監査を受けておりますが、第6期の財務諸表については、監査を受けておりません。
8.配当性向は、当社は配当を実施しておりませんので記載しておりません。
9.従業員数欄の「〔外書〕」は、臨時従業員数(派遣社員含む)の年間平均雇用人員であります。
2 【沿革】
Section titled “2 【沿革】”当社は、平成16年4月秋田県秋田市において未充足医療ニーズ(Unmet Medical Needs=UMN)を満たす新規医療用医薬品の研究開発及び製造販売を目的とする会社として設立いたしました。未充足医療領域における医薬品のパイオニアとなるべく、積極的に事業展開を図っております。
平成18年8月、米国のProtein Sciences Corporation1)(以下、「PSC」といいます。)より、Baculovirus Expression Vector System(以下、「BEVS」といいます。) 2)技術を用いた組換え3)インフルエンザHA4)ワクチンの、日本国内における独占的な開発、製造及び販売権を取得し、季節性組換えインフルエンザHAワクチン(多価5))(開発コード:UMN-0502 以下、「UMN-0502」といいます。)、組換えインフルエンザHAワクチン(H5N16))(開発コード:UMN-0501 以下、「UMN-0501」といいます。)の開発を開始いたしました。また、平成18年10月に秋田研究所を開設し、当該パイプラインの基礎的な研究を開始いたしました。平成20年12月に、横浜本社を設置するとともに、平成21年7月には横浜研究所を開設し、研究開発体制の拡充を図りました。平成22年1月に株式会社IHIとUMN-0502及びUMN-0501原薬製造事業の協業に関する基本協定を締結し、原薬供給体制の整備を開始いたしました。平成22年4月に秋田県秋田市に組換えインフルエンザHAワクチン原薬7)生産施設(以下、「秋田工場」といいます。)の建設を開始するとともに、平成22年5月には株式会社IHIとの協業に関する基本協定に基づき、株式会社UNIGENを設立いたしました。また、平成22年9月にアステラス製薬株式会社とUMN-0502及びUMN-0501の共同事業化に関する提携を行うとともに、平成22年11月には、PSCより東アジア主要国における上記パイプラインの独占的事業化権を取得し、アジア市場への参入を図るべく事業展開を行っております。さらに、H5N1亜型以外のインフルエンザの世界的流行(パンデミック)に備え、組換えインフルエンザHAワクチン(H9N28))(開発コード:UMN-0901 以下、「UMN-0901」といいます。)の開発を開始いたしました。平成23年4月には秋田工場が稼動するとともに、平成25年5月には株式会社UNIGENが岐阜県揖斐郡池田町に建設した組換えインフルエンザHAワクチン原薬実生産施設及びバイオ医薬品原薬生産施設(以下、「岐阜工場」といいます。)が竣工し、当社グループとして製品供給体制の確立を図っております。平成24年1月には、フィンランドのタンペレ大学ワクチン研究センターのヴェシカリ教授、ブラゼヴィッチ博士より、組換えノロウイルスVLP(Virus Like Particle)9)+組換えロタウイルスVP610)混合ワクチンの全世界における独占的事業化権を取得し、ウイルス性胃腸炎ワクチン(開発コード:UMN-2003 以下、「UMN-2003」といいます。)の開発を開始いたしました。また、これらの医療用医薬品事業に加えて、平成24年7月にアピ株式会社と秋田工場及び岐阜工場を活用したバイオ医薬品受託製造(Biopharmaceutical contract manufacturing organization、以下、「BCMO」といいます。)事業の協業に関する契約を締結いたしました。平成24年12月には東京証券取引所マザーズ市場に株式を上場するとともに、米国のCatalent Pharma Solutions,Inc.(以下、「Catalent Pharma Solutions,Inc.」といいます。)とバイオ後続品の生産株を非独占で供給を受ける契約、並びに韓国の日東製薬株式会社(以下、「日東製薬株式会社」といいます。)とUMN-0502、UMN-0501及びUMN-0901の韓国での共同開発、独占的販売に関する契約を締結いたしました。また、平成25年3月にアピ株式会社及び株式会社ヤクルト本社とがん領域における複数の抗体バイオ後続品の研究開発及び商業化を共同で実施すること及びその基本事項について合意し、意図確認書を締結するとともに、これに基づき平成25年6月及び同年12月には共同事業契約を締結いたしました。さらに、平成25年10月に台湾の國光生物科技股份有限公司(以下、「國光生物科技股份有限公司」といいます。)とUMN-0502、UMN-0501及びUMN-0901の台湾及び中国における商業化に関する優先交渉権を供与する契約を締結いたしました。また、平成26年2月に、第一三共株式会社とノロウイルスワクチンの共同研究契約を締結いたしました。これに伴い、組換えノロウイルスVLP単独ワクチン(開発コード:UMN-2002 以下、「UMN-2002」といいます。)を開発パイプラインとして新たに設定いたしました。
当社設立以後の企業集団に係る経緯は、次のとおりであります。
| 年月 | 事項 |
|---|---|
| 平成16年4月 | 未充足医療ニーズを満たす新規医療用医薬品の研究開発及び製造販売を目的として、秋田県秋田市に株式会社UMNファーマを設立 |
| 平成16年12月 | 東京支社を東京都港区に開設 |
| 平成17年6月 | 東京支社を東京都目黒区に移転 |
| 平成18年3月 | 東京支社を東京本社に名称を変更 |
| 平成18年6月 | 東京本社を東京都目黒区から東京都渋谷区に移転 |
| 平成18年8月 | PSCと、組換えインフルエンザHAワクチンの日本における開発、製造及び販売に関する独占的実施権許諾契約を締結 |
| 平成18年10月 | 秋田大学医学部内に秋田研究所を開設 |
| 平成19年4月 | 石川島播磨重工業株式会社(現 株式会社IHI)とUMN-0502及びUMN-0501の原薬製造プロセスに関する共同研究契約を締結 |
| 平成20年4月 | 秋田県秋田市に組換えインフルエンザHAワクチン原薬製造施設用地を取得 |
| 年月 | 事項 |
|---|---|
| 平成20年6月 | UMN-0501の第Ⅰ/Ⅱ相臨床試験を国内にて開始UMN-0501が希少疾病用医薬品(オーファンドラッグ)11)に指定 |
| 平成20年8月 | 株式会社IHIプラントエンジニアリングとUMN-0502及びUMN-0501原薬製造施設の詳細設計に関する契約を締結 |
| 平成20年12月 | 東京本社を東京都渋谷区から神奈川県横浜市港北区に移転し横浜本社に名称を変更 |
| 平成21年10月 | UMN-0501の第Ⅱ相臨床試験を国内にて開始 |
| 平成22年1月 | 株式会社IHIとUMN-0502及びUMN-0501原薬製造事業の協業に関する基本協定を締結 |
| 平成22年4月 | アピ株式会社とUMN-0502及びUMN-0501製剤化工程の委託に関する基本協定書を締結秋田県秋田市にて組換えインフルエンザHAワクチン原薬製造施設の建設を開始 |
| 平成22年5月 | 株式会社UNIGENを設立、当社連結子会社となる |
| 平成22年7月 | 厚生労働省「新型インフルエンザワクチン開発・生産体制整備臨時特例交付金」交付事業(第一次分)に採択 |
| 平成22年9月 | アステラス製薬株式会社と国内における細胞培養インフルエンザワクチン共同事業化に関する提携契約を締結 |
| 平成22年10月 | UMN-0501のブースター12)試験を開始 |
| 平成22年11月 | PSCより、UMN-0502及びUMN-0501の中国・韓国・台湾・香港・シンガポールにおける独占的事業化権を追加取得 |
| 平成23年3月 | アピ株式会社とUMN-0502及びUMN-0501の製剤化工程の独占的業務委託に関する「製造委託基本契約書」を締結 |
| 平成23年4月 | 秋田工場が稼動 |
| 平成23年8月 | UMN-0501高用量試験を開始UMN-0502第Ⅰ/Ⅱ相臨床試験を開始 |
| 平成23年12月 | UMN-0502第Ⅰ/Ⅱ相臨床試験において免疫原性13)及び良好な忍容性14)を確認 |
| 平成24年1月 | UMN-2003の全世界における独占的事業化権をタンペレ大学ワクチン研究センターのヴェシカリ教授・ブラゼヴィッチ博士より取得 |
| 平成24年2月 | 株式会社UNIGENが経済産業省「平成23年度国内立地推進事業費補助金」一次公募に採択 |
| 株式会社UNIGENが株式会社三井住友銀行をアレンジャーとするシンジケートローン契約を締結 | |
| 平成24年3月 | BEVS技術を用いたバイオ医薬品原薬生産施設である岐阜工場の建設を開始 UMN-0501の高用量試験において免疫原性及び良好な忍容性を確認 |
| 平成24年7月 | アピ株式会社とバイオ医薬品受託製造事業に関する「BCMO事業協業に関する基本合意書」を締結 |
| 平成24年10月 | 日東製薬株式会社とUMN-0502、UMN-0501及びUMN-0901の韓国での共同開発、独占的販売に関する基本合意書を締結 |
| 平成24年12月 | 東京証券取引所マザーズ市場に株式を上場 Catalent Pharma Solutions,Inc.とバイオ後続品の生産細胞株を非独占で提供を受ける契約を締結 日東製薬株式会社とUMN-0502、UMN-0501及びUMN-0901の韓国での共同開発、独占的販売に関する契約を締結 |
| 平成25年3月 | アピ株式会社及び株式会社ヤクルト本社とがん領域における複数の抗体バイオ後続品の研究開発及び商業化を共同で実施すること及びその基本事項に関する意図確認書を締結 |
| 平成25年4月 | 横浜本社を神奈川県横浜市港北区から神奈川県横浜市西区に移転 |
| 平成25年5月 | 岐阜工場が竣工 |
| 平成25年6月 | アピ株式会社及び株式会社ヤクルト本社とがん領域における抗体バイオ後続品に関する共同事業契約を締結 |
| 平成25年7月 | 和光純薬工業株式会社と抗体バイオ医薬品用培地の開発に関する覚書を締結 |
| 平成25年10月 | 國光生物科技股份有限公司とUMN-0502、UMN-0501及びUMN-0901の台湾及び中国における商業化に関する優先交渉権を供与する契約を締結 |
| 平成25年11月 | 国立感染症研究所からのワクチン候補抗原製造を受託 |
| 平成25年12月 | アピ株式会社及び株式会社ヤクルト本社とがん領域における追加の抗体バイオ後続品に関する共同事業契約を締結 |
| 平成26年1月 | UMN-0502第Ⅲ相臨床試験の2試験において免疫原性及び安全性に大きな問題がないことを確認 |
| 平成26年2月 | 第一三共株式会社とノロウイルスワクチンの共同研究契約を締結 |
3 【事業の内容】
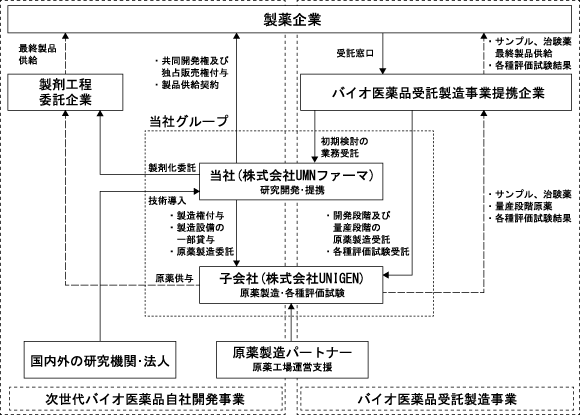
Section titled “3 【事業の内容】”(1)当社グループの事業概要
Section titled “(1)当社グループの事業概要”当社は、製薬業界で培った豊富な開発経験と幅広いネットワークを駆使し、満足な治療法や製造技術のない領域にて、革新的な医薬品を迅速に開発することを会社のミッションに掲げ、平成16年4月に設立されました。
当社グループは、当社及び連結子会社(株式会社UNIGEN)により構成されております。当社独自の製造プラットフォーム15)を保有することにより、次世代バイオ医薬品自社開発事業に加え、バイオ医薬品の製造も事業領域とするバイオファーマ企業であります。当該コンセプトを基に、開発パイプラインごとに対象疾患領域及び臨床現場の状況、競合する医薬品の状況などを総合的に勘案し、医薬品としての価値を最大化できる最適のタイミングで国内外の製薬企業と提携しライセンスアウトすることのみならず、自ら原薬を製造し製品を供給することで収益を確保していくビジネスモデルを基本としております。一方、バイオ医薬品受託製造事業については、当社グループが保有する横浜研究所、秋田工場及び岐阜工場、これら研究・生産施設に従事する製造ノウハウに長けた人材を活用し、開発初期から商用段階まであらゆる顧客ニーズに対応しつつ、高い品質の製品を供給していくビジネスモデルを基本としております。受注活動をバイオ医薬品受託製造事業提携企業とともに行い、当該提携企業を通じて顧客に対して検討用サンプル、治験薬、製品、これらに係る各種評価試験結果等を供給いたします。
なお、当社グループは医療用医薬品の研究開発及びこれに関連する事業の単一セグメントであるため、セグメント別の記載を省略しております。
以下に当社グループの事業系統図を示します。
<当社グループの事業系統図>
また、当社グループの事業の特徴は以下のとおりであります。
① 当社独自の製造プラットフォームを保有
Section titled “① 当社独自の製造プラットフォームを保有”当社は、PSCより、UMN-0502、UMN-0501及びUMN-0901をはじめとする組換えインフルエンザHAワクチンに関する日本、中国、韓国、台湾、香港及びシンガポールにおける、独占的な開発、製造及び販売に関する権利を取得しております。また、タンペレ大学より、UMN-2003の全世界における独占的事業化権を取得しております。これら開発パイプラインの製造技術であるBEVSを製造プラットフォームと位置づけ、日本国内でBEVSによるバイオ医薬品の開発から製造までを一貫して担う体制を構築しております。生産体制の確立に当たり、平成22年1月に、組換えインフルエンザHAワクチンの原薬製造事業を共同で行うべく、株式会社IHIと当該事業の「協業に関する基本協定書」を締結いたしました。平成22年5月に、原薬製造事業を主な事業目的とする株式会社UNIGENを設立、当社連結子会社といたしました。平成22年6月に、当社及び株式会社IHIより株式会社UNIGENに対して増資を行い、原薬製造事業の協業活動を本格的に開始いたしました。平成22年7月に、厚生労働省「新型インフルエンザワクチン開発・生産体制整備臨時特例交付金」交付事業(第一次分)に採択され、当該助成金にて秋田県秋田市に組換えインフルエンザHAワクチン原薬生産施設(秋田工場)の建設を開始、平成23年4月に稼働いたしました。また、平成24年3月には、インフルエンザワクチンをはじめとしたバイオ医薬品原薬を量産することを目的として岐阜県揖斐郡池田町に岐阜工場の建設を開始、平成25年5月に竣工いたしました。一方、新たなパイプラインであるUMN-2003は、BEVSにより製造したノロウイルス組換えVLP及びロタウイルスの組換えウイルスタンパクを有効成分とするワクチンであります。また、UMN-2002としてノロウイルス組換えVLPを主成分とするワクチンの開発を開始しております。VLPワクチンは、アジュバント16)を用いずに免疫原性を高める方法として注目を集めており、BEVSによるVLPワクチン原薬製造にも組換えインフルエンザHAワクチンで得られた知見を最大限に活用いたします。
② 感染症予防ワクチンを中心とする複数のパイプラインを開発
Section titled “② 感染症予防ワクチンを中心とする複数のパイプラインを開発”当社グループは、インフルエンザ、ノロウイルス、ロタウイルスなど、ウイルス感染症領域における複数の開発パイプラインを有しております。また当社は、自社にて前期臨床試験を行うだけでなく、後期臨床試験をライセンスアウト先と共同開発できる体制を整えており、かつ、秋田工場にて治験薬を供給する体制も整備しております。現在、日本国内において、UMN-0502及びUMN-0501をアステラス製薬株式会社と共同開発しております。また、流行するインフルエンザウイルスの動向を踏まえ、UMN-0901の開発も行っております。さらに、UMN-2003及びUMN-2002をパイプラインに加え、全世界のマーケットを目指して開発を開始しており、当社グループの製造プラットフォームであるBEVSを最大限に活用できる医薬品候補シーズ探索を積極的に実施しております。
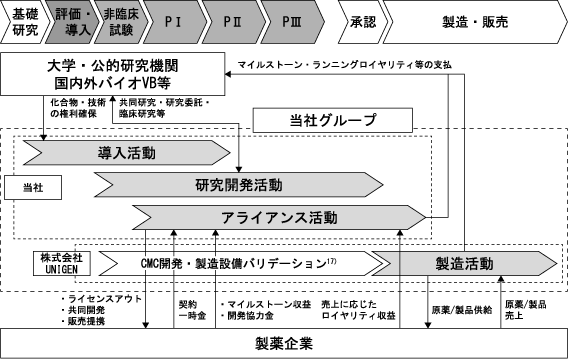
③ 単なるライセンスによる対価のみに留まらない収益構造の確立
Section titled “③ 単なるライセンスによる対価のみに留まらない収益構造の確立”以下図表に示すとおり、当社グループは、医薬品候補シーズの探索に当たり、市場性、上市の可能性や製造技術を十分検討いたします。一義的にはBEVSにて製造が可能な医薬品候補シーズを優先的に開発することで、製品供給による収益を実現することにより、当社資産から生まれる付加価値の最大化を目指しております。
また、基礎研究・臨床開発を進める過程において、新たな製造技術の導入も視野に入れながら、医薬品としての価値を最大化できる最適のタイミングにて、国内外の製薬企業と提携しライセンスアウトいたします。製薬企業との提携による契約一時金や、基礎研究・臨床開発・承認申請等の進捗状況によりマイルストーン収入を受けること、販売のライセンスアウトに伴う売上の一定率のロイヤリティ収入や販売目標達成時の一時金を得ることに加え、最先端のバイオ医薬品製造技術に基づく原薬製造による売上を得る等、単なる知的財産権の使用に係る収益のみに留まらない事業体制の整備を図っております。
<当社グループの事業モデル>
(2)医薬品の研究開発プロセスと当社グループの事業が関連するプロセス領域について
Section titled “(2)医薬品の研究開発プロセスと当社グループの事業が関連するプロセス領域について”医療用医薬品を製造、販売するためには厳格な規制が存在し、これら規制を遵守しながら開発を進めていかなければなりません。医療用医薬品が販売されるまでに実施される一般的な研究開発の目的及び内容並びに各段階における関連規制について説明いたします。
<医薬品の開発プロセス>
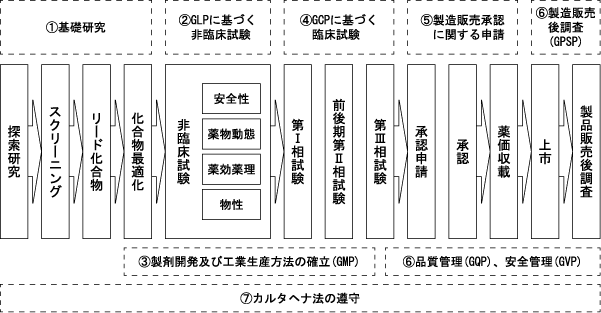
大別すると、① 基礎研究、② GLPに基づく非臨床試験、③ 製剤開発及び工業生産方法の確立(GMP)、④ GCPに基づく臨床試験、⑤ 製造販売承認に関する申請、⑥ GQP、GVP及びGPSPの6つのステップに区分されます。さらに、バイオ医薬品製造のプロセスのひとつに遺伝子組換え技術が存在するため、⑦ 遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(カルタヘナ法)の遵守、を加え、以下に各ステップについて詳細を記載いたします。
① 基礎研究
Section titled “① 基礎研究”ターゲットとする疾患を決定し、将来医薬品となる可能性のある物質を特定して、試験管内(以下、「in vitro」といいます。)もしくは動物(以下、「in vivo」といいます。)による疾患モデルを確立し、スクリーニングにかけて、リード化合物18)の選定を行います。当該リード化合物の物理的・化学的特性を確認した後、化学修飾19)を行い、in vivo実験により、高い安全性と有効性を有する開発候補化合物を選定いたします。その後、信頼性基準20)に基づき、大型哺乳動物などでより精緻に薬効・安全性の確認を行うとともに、投与方法や製造方法の検討を行うために、物性試験21)、薬物動態試験22)等を実施いたします。
② GLPに基づく非臨床試験
Section titled “② GLPに基づく非臨床試験”GLP(Good Laboratory Practice)とは、臨床試験を始めるに当たって特にヒトでの安全性を推測できるデータを取得するものであり、単回毒性試験23)、反復毒性試験24)、がん原性試験25)、変異原性試験26)などを実施し、化合物の安全性に関するデータを収集いたします。一定の安全性の検証を行うための基準として、「医薬品の安全性に関する非臨床試験の実施の基準に関する省令」(平成9年3月26日厚生省令第21号 最終改正平成20年6月13日厚生労働省令第114号)に、試験方法、実施者、設備等が厳格に定められております。一連の非臨床試験データを揃え、臨床試験の目的及び具体的内容について治験届を当局に提出し、その内容について当局より確認を得た後に、臨床試験を開始することになります。
③ 製剤開発及び工業生産方法の確立
Section titled “③ 製剤開発及び工業生産方法の確立”製剤開発は非臨床試験の前後より開始いたします。製剤の処方設計を行い、臨床試験に使用する治験薬を製造いたします。治験薬の製造には、治験薬GMP(Good Manufacturing Practice 「治験薬の製造管理及び品質管理基準」及び「治験薬の製造施設の構造設備基準」(平成9年3月31日薬発第480号 最終訂正平成20年7月9日薬食発第0709002号))に従わなければなりません。さらに、上市後の製品の製造に向けて工業生産方法の確立が必要になります。そのためには、GMP「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」(平成6年1月27日厚生省令第3号 最終改正平成16年12月24日厚生労働省令第179号)に定められた基準に従って製造を行う必要があり、当該GMPに準拠して製造がなされているかどうかについて当局からの査察等が実施されます。なお、GMP基準は医薬品製造業の許可要件並びに医薬品製造販売の承認要件となっております。GMP適合施設を保有するために、これら厳密な規制を完全にクリアする必要があります。
④ GCP基準に基づく臨床試験
Section titled “④ GCP基準に基づく臨床試験”臨床試験については、GCP(Good Clinical Practice 「医薬品の臨床試験の実施の基準に関する省令」(平成9年3月27日厚生省令第28号 最終改正平成24年12月28日厚生労働省令第161号))が定められており、医薬品の製造承認の申請に際し必要な臨床試験成績に関する各種資料の取得、管理、治験実施者の選定・依頼及び実施等について厳格な基準が定められております。
第Ⅰ相臨床試験は、少数の健康人に与薬し、薬物動態や安全性の確認を行います。第Ⅱ相臨床試験の前期では、少数患者に与薬し、安全性と有効性について確認を行います。この段階で、具体的な適応疾患及び投与用量のおおよその範囲について決定いたします。いわゆるPOC(Proof of Concept ヒトでの有効性の実証)は、前期第Ⅱ相臨床試験にて相応の薬効が示唆された段階をいいます。それに続く後期第Ⅱ相臨床試験では、対象数を増やして投与用量と効果の相関性を確認し、至適条件を決定いたします。第Ⅲ相臨床試験では、一般臨床上、安全性と有効性が確認されるのに十分な数の患者に対して、類似薬もしくは偽薬(プラセボ)27)との二重盲検比較試験28)を実施し、その医薬品が治療に貢献するものであるか否かの最終的な確認を行います。
なお、医薬品の開発については、平成3年に日米欧の薬事規制当局及び製薬団体によって設立されたICH(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use「医薬品規制ハーモナイゼーション国際会議」)によって、世界レベルで臨床試験データの融和が図られております。主に国や地域間で承認申請データを相互活用し新規医薬品開発を効率化しようとするものであり、平成10年、海外臨床試験データ受け入れに関するガイドラインが最終合意されたことにより、一定の確認試験を実施すること等を条件に、異なる地域での臨床試験データを共有した承認申請が可能となっております。
⑤ 製造販売承認に関する申請
Section titled “⑤ 製造販売承認に関する申請”品質試験、非臨床試験及び臨床試験の資料をまとめて製造販売の承認申請を行います。医薬品の成分・分量、用法・用量、効能・効果、副作用等に関する審査を行ったうえで、厚生労働大臣が品目ごとに承認を与えます。また、業として医薬品を製造する者は、医薬品製造業の許可を受けなければなりません。
⑥ GQP、GVP及びGPSP
Section titled “⑥ GQP、GVP及びGPSP”医薬品の製造販売を行う場合、品質管理に関する基準としてGQP(Good Quality Practice 「医薬品、医薬部外品、化粧品及び医療機器の品質管理の基準に関する省令」(平成16年9月22日厚生労働省令第136号 最終改正平成17年11月24日厚生労働省令第164号))を遵守する必要があります。
一方、GVP(Good Vigilance Practice「医薬品、医薬部外品、化粧品及び医療機器の製造販売後安全管理の基準に関する省令」(平成16年9月22日厚生労働省令第135号 最終改正平成25年3月11日厚生労働省令第26号))として、医療機関等からの自発報告や文献・学会報告等から副作用や感染症に関する情報等の安全性情報を収集し、評価・検討の上、安全確保措置を講じる必要があります。GQP及びGVPは医薬品製造販売業の許可要件となっております。
製造販売後、医薬品の有効性と安全性を再審査及び再評価するために必要な情報等の収集・分析・報告に関する管理及び実施体制が、GPSP(Good Post-marketing Study Practice 「医薬品の製造販売後の調査及び試験の実施の基準に関する省令」(平成16年12月20日厚生労働省令第171号 最終改正平成25年3月11日厚生労働省令第26号))に定められております。
これらGQP、GVP及びGPSPは、医薬品製造販売業許可を取得する者がその責任を負うことになります。
⑦ 遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(カルタヘナ法)の遵守
Section titled “⑦ 遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(カルタヘナ法)の遵守”国際的に、生物多様性条約が平成4年に採択され、翌年より発効いたしました。これを受けて、平成12年には生物の多様性を守るため、遺伝子組換え生物等の安全な取り扱い等につき、バイオセーフティに関するカルタヘナ議定書が採択され、平成15年より発効しております。本議定書は平成25年12月現在、193の国及び地域が批准・締結をしております。通称「カルタヘナ法」は、「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」として、国際協調に基づき各国で立法化されており、日本では平成15年に法律が成立・公布され、平成16年より施行されております。これにより、遺伝子組換え生物の封じ込めが厳格に規定されており、違反した場合、罰則が存在いたします。遺伝子組換え生物を取り扱う研究室や工場の運営に当たっては、本法律の遵守が必須であります。
上記の医薬品の開発プロセスにおいて、当社が関連する領域は、医療用医薬品事業においては、① 基礎研究から⑦ カルタヘナ法の遵守までの領域のうち、⑥ 品質管理、安全管理及び製造販売後調査以外の全てとなります。当社グループは、ヒトの生命に関連する医薬品を開発する企業として、これらの法令・規制を徹底的に遵守する体制を整備し、事業を進めております。
<当社グループが主に関連するプロセス領域と遵守すべき法令・規制等>
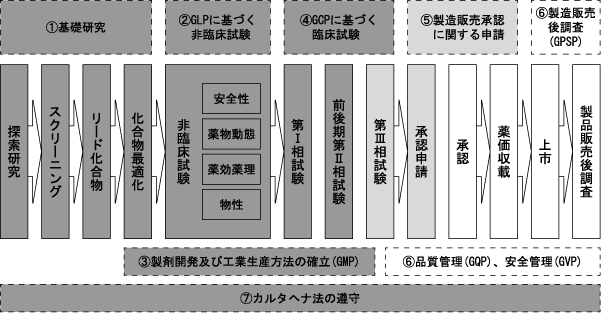
(注)網掛け領域が、現時点における当社グループ事業に関連する開発プロセス領域となります。
(3)当社グループの製造プラットフォームについて
Section titled “(3)当社グループの製造プラットフォームについて”① BEVSとは
Section titled “① BEVSとは”BEVSは、標的インフルエンザウイルスHAタンパクの全長遺伝子を遺伝子組換え技術によってバキュロウイルス(Autographa californica Nuclear Polyhedrosis Virus)29)に挿入し、これを株化30)した昆虫細胞に感染させ、細胞内で目的のタンパクを大量に発現できることに大きな特徴を有しております。BEVSは、組込む遺伝子の種類が変わっても生産条件を大きく変える必要がない、柔軟で効率的な製造技術であり、一部のタンパクの大量生産に向くため、低コストでタンパク医薬品を作ることができることから、バイオ医薬品製造技術の中でも有望なものの一つであります。
当社の技術導入元であるPSCがBEVSを用いて開発した季節性インフルエンザワクチンFlublok®は、米国食品医薬品局(Food and Drug Administration:FDA)より承認を得ており、製造技術として確固たる地位を築くに至っております。BEVSを用いて製造されたワクチンには、この他にも、平成23年にFDAにより承認された前立腺がん治療ワクチンProvenge®(Dendreon Corporation社製)があります。ワクチン以外では、欧州医薬品庁(European Medicines Agency:EMA)より承認されたリポ蛋白リパーゼ欠損症治療薬のGlybera®(UniQure BV社製)もBEVSを用いて製造されております。
当社が開発を行っているUMN-0502、UMN-0501、UMN-0901、UMN-2003及びUMN-2002は、BEVSを用いて製造した組換えタンパク及び組換えVLPを有効成分とするワクチンであります。
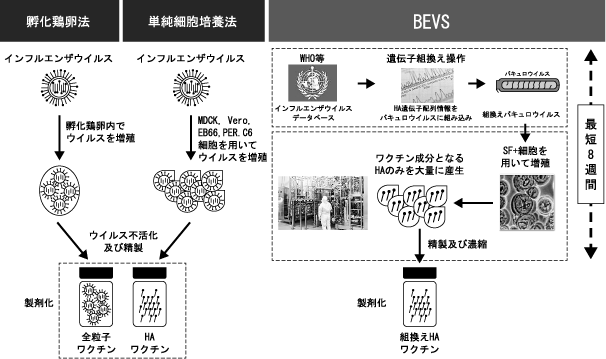
② 他の製造技術との比較 ―インフルエンザワクチンの例―
Section titled “② 他の製造技術との比較 ―インフルエンザワクチンの例―”日本において製造販売されているインフルエンザワクチンは、孵化鶏卵中で増やしたウイルスを成分または全粒子の形で製剤化したものであります。しかし、この孵化鶏卵法では、インフルエンザの世界的流行(パンデミック)が起こった場合、孵化鶏卵の供給が追いつかず、全国民へのワクチン供給に1年以上を要してしまうこと、細胞毒性の強いウイルスの場合には、野生型のウイルスは培養が困難であること、ウイルスの鶏卵培養への馴化31)に時間がかかること、及び抗原性が変化してしまう可能性があること等の問題点があり、それらを克服すべく細胞培養法によるインフルエンザワクチンの開発が進められております。
次世代の鶏卵を使用しない細胞培養による製造法には、BEVSの他に、イヌ腎臓尿細管上皮由来細胞(Madin-Darby canine kidney(MDCK)細胞)、アフリカミドリザル腎臓上皮由来細胞(Vero細胞)、ヒト胚網膜芽細胞(PER.C6細胞)、アヒル胚由来幹細胞(EB66細胞)等を用いて増やしたインフルエンザウイルスを製剤化する方法が挙げられます。これらの細胞培養による製造方法は、インフルエンザウイルスをより増殖しやすいよう、鶏卵から他の哺乳動物の細胞系に置き換えたものであることから、インフルエンザウイルスそのものを用いることには変わりありません。
一方、当社グループのBEVSは、インフルエンザウイルスそのものを使用せずワクチンの成分であるHA遺伝子情報のみで製造が可能であり、組込む遺伝子の種類が変わっても生産条件を大きく変える必要がないため、短期間かつ大量に製造することができることから、インフルエンザワクチンの生産には非常に有利であると考えております。
<インフルエンザワクチン製造方法比較図>
③ 当社とPSCとの契約について
Section titled “③ 当社とPSCとの契約について”当社は、平成18年8月に、日本におけるBEVSを用いた組換えインフルエンザHAワクチンの独占的な開発、製造及び販売権をPSCより取得し、BEVSに関する技術移管を行ってまいりました。当社の横浜研究所及び秋田研究所において実施した様々な研究開発活動により、培養と精製を中心とする工程を確立するに至るとともに、秋田県秋田市にPSCが保有するGMP製造施設と同様の培養規模である600Lスケール原薬生産施設である秋田工場のほか、岐阜県揖斐郡池田町に21,000Lスケール実生産施設である岐阜工場を整備し、製造工程の技術移管を完了しております。また平成22年11月、当社はPSCとの間で本独占的事業化権を中国・韓国・台湾・香港・シンガポールに拡大する契約を締結しております。当社グループは、急速な経済発展が見込まれる一方で季節性やパンデミックインフルエンザ対策に力を注ぎつつあるこれらの国と地域において、開発・製造・承認申請・販売に係る各国の規制環境に合わせた事業展開を行うことが可能となっております。
④ BEVSの発展性
Section titled “④ BEVSの発展性”BEVSは、インフルエンザワクチンへの適応性と応用性に非常に富んでおり、H5N1亜型以外に他の動物からヒトへの感染拡大が懸念されているインフルエンザウイルス株(H9N2亜型やH7N9亜型32)など)に適用可能であります。さらに、インフルエンザウイルスのHA以外のターゲットであるノイラミニダーゼ(Neuraminidase、以下、「NA」といいます。)33)をBEVSにて生産し、HAとNAとを混合したワクチンの研究開発もなされております。またBEVSは、デング熱、西ナイル熱など複数の新興・再興感染症に対する組換えサブユニットワクチン、ノロウイルスワクチンなど組換えサブユニットワクチンをさらに発展させたVLPワクチン、がんなどを対象とするペプチド治療ワクチン、タンパク治療薬等へと幅広く応用できる可能性を有しております。
(4)当社グループの開発・製造実施体制について
Section titled “(4)当社グループの開発・製造実施体制について”① 当社グループの重点領域と人材について
Section titled “① 当社グループの重点領域と人材について”当社グループでは、製造プラットフォームであるBEVSの価値を最大化することを目的に、基礎研究や臨床開発のみならず製品供給までを重点活動領域としております。そのため、当社グループの取締役会及び研究・製造・生産・臨床開発の各組織は、製薬企業で長年研究開発や申請業務を経験した人材を中心に構成されております。各種ワクチンの開発及び承認申請経験を有する人材を臨床開発部に配置し、臨床試験を進めております。また、製造販売承認後、当社グループより製品供給を行うために、医療用医薬品工場の生産ライン部門、品質管理部門並びに品質保証部門にて実務経験のある人材を積極的に採用しており、GMPに準拠した医薬品製造施設の運営体制を構築しております。
② 当社グループの研究施設と原薬生産施設について
Section titled “② 当社グループの研究施設と原薬生産施設について”多くの日本国民に安定した組換えワクチンを供給するため、BEVSの製造施設と研究室を国内に保有することが当社にとって必要不可欠であります。これまで、臨床開発だけでなく製造開発・生産施設建設にも資金を投入してまいりました。
現在、当社は2つの研究施設を有しております。秋田大学医学部内にある秋田研究所では、動物実験等の基礎的研究を行っております。また、横浜研究所では、BEVSを用いて、カルタヘナ法に準拠した20Lから250Lスケールまでのパイロット培養が可能な培養槽をもつ製造実験設備を保有し、製造工程となる培養及び精製に関する初期検討を実施しております。また品質管理・工程管理に関する評価試験法の研究も行っております。
また、当社グループは、秋田県秋田市御所野湯本の秋田新都市産業団地内に約13,000㎡の敷地内に延べ面積約3,000m2、600L培養槽3基を設置する治験薬GMP34)準拠のパイロットスケール原薬生産施設となる秋田工場を有しております。秋田工場は、平成22年7月より平成23年3月までを助成期間とした厚生労働省「新型インフルエンザワクチン開発・生産体制整備臨時特例交付金」交付事業(第一次分)における実験用生産施設整備事業の助成金にて整備し、平成23年4月より稼働しております。秋田工場の運営は株式会社UNIGENが行っており、徹底したGMP教育や管理教育を継続的に実施し、製造ライン要員の育成にも努めております。
さらに、株式会社UNIGENは、平成24年2月に経済産業省「平成23年度国内立地推進事業費補助金」の採択を受けるとともに、同月に株式会社三井住友銀行をアレンジャーとするシンジケートローンを組成、同年3月より岐阜県揖斐郡池田町にGMP適合予定の実生産施設として岐阜工場の建設を開始し、平成25年5月に竣工いたしました。岐阜工場は、延べ面積約14,000㎡に21,000Lスケール培養槽2基を設置し、相応の生産能力を有する生産施設であります。なお、岐阜工場は、上記スケール培養槽を最大で8基まで増設することが可能であり、秋田工場と同様にBEVS以外のバイオ医薬品の原薬製造にも転用可能な設計となっており、当社開発パイプライン以外のBCMO事業の拠点機能も担っております。
<当社グループの製造拠点>

(5)当社の開発パイプライン(開発中の品目)
Section titled “(5)当社の開発パイプライン(開発中の品目)”現在、下記パイプラインの開発が進行中であります。
<当社の開発パイプラインと開発進捗状況>
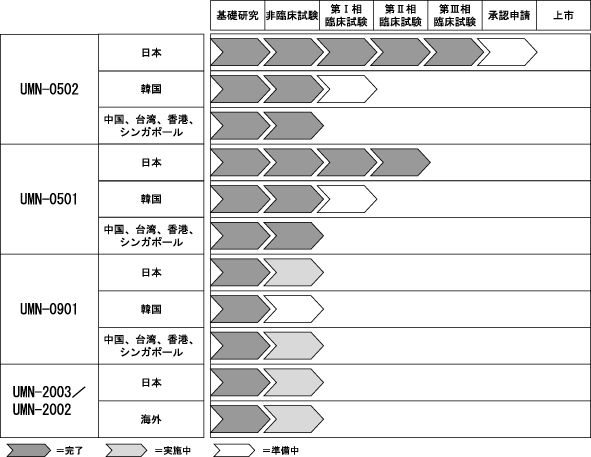
① 開発コード:UMN-0502(季節性組換えインフルエンザHAワクチン(多価))
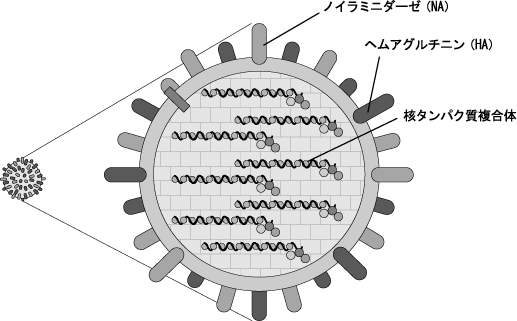
Section titled “① 開発コード:UMN-0502(季節性組換えインフルエンザHAワクチン(多価))”UMN-0502は、一般的には季節性インフルエンザワクチンに当たるもので、毎年冬のシーズンに接種する予防ワクチンであります。
インフルエンザウイルスには、A・B・Cの3型があり、特にA型とB型は感染性が強く流行しやすいことからワクチンによる予防の対象となっております。これらのウイルス粒子表面にはHAとNAという2つの糖タンパクが存在しております。HAはインフルエンザウイルスが細胞に進入する際に機能するタンパクであり、NAは細胞内で増殖したウイルスが細胞外に出る際に機能するタンパクであります。これらが感染防御免疫の標的抗原とされております。A型に関しては、少なくとも16種類のHAが存在し、9種類あるNAとの組み合わせにより、ウイルスのタイプが決定されます。例えばH1N1インフルエンザウイルスは、HAの1番目の亜型とNAの1番目の亜型の組み合わせで構成されております。
<インフルエンザウイルスの構造>
UMN-0502は、主としてHAタンパクを抗原としてヒトに免疫応答を誘導する薬剤であり、H1N1の亜型、H3N2の亜型、B型のウイルス3株にあたる3種のHAが入った組換えインフルエンザHAワクチンであります。米国ではPSCがFlublok®の商標にてFDAより承認を取得しております。PSCが米国にて承認を取得するにあたり、第Ⅲ相臨床試験までに実施した臨床試験は合計12試験あり、参考試験である医師主導試験を含め、合計4,163例の被験者に対してFlublok®(UMN-0502)が接種されております。検討したすべての用量での良好な安全性と忍容性が示されており、当社は次世代を担うインフルエンザワクチンになると考えております。
日本においては、アステラス製薬株式会社と共同で、平成23年8月より第Ⅰ/Ⅱ相臨床試験を実施いたしました。当該試験は、20歳以上50歳未満の健康な成人男女を対象とし、1群55例計3群165例に対して接種が行われ、平成23年12月に承認要件を満たす免疫原性と優れた忍容性が確認されました。当該試験結果を受けて、平成24年11月より65歳以上高齢者1,060名を対象とした第Ⅲ相臨床試験を開始、平成25年3月に、国内既承認孵化鶏卵ワクチンに対し、免疫原性において非劣性基準を満たすとともに、安全性に大きな問題がないことが確認されました。平成25年10月より、年齢層を変えて20歳以上65歳未満の健康成人900名を対象とした同様の第Ⅲ相臨床試験を開始、平成26年1月に、高齢者に対する第Ⅲ相臨床試験と同様に国内既承認孵化鶏卵ワクチンに対し、免疫原性において非劣性基準を満たすとともに、安全性に大きな問題がないことが確認されました。また、これら第Ⅲ相臨床試験に加え、筋肉内接種での免疫原性及び安全性を確認することを目的として、61歳以上の成人55名を対象とした試験を実施、平成26年1月に、良好な免疫原性が確認されるとともに、安全性に大きな問題がないことが確認されました。これらの臨床試験結果を受け、国内において承認申請の準備を進めております。
また、東アジア主要国への展開を開始しており、韓国においては、平成24年12月に締結した日東製薬株式会社との共同開発及び独占的販売に関する契約に基づき、PSC及びアステラス製薬株式会社が実施した米国及び日本での臨床試験結果を活用し、早期承認を得るべくブリッジング試験を積極的に進める計画であります。台湾及び中国においては、平成25年10月に國光生物科技股份有限公司に対して商業化に関する優先交渉権を供与する契約を締結しております。
② 開発コード:UMN-0501(組換えインフルエンザHAワクチン(H5N1))
Section titled “② 開発コード:UMN-0501(組換えインフルエンザHAワクチン(H5N1))”UMN-0501は、近年世界的流行の危険性が指摘され、世界レベルでその対応が急務となっている高病原性鳥インフルエンザウイルスH5N1亜型に対する予防ワクチンであります。
インフルエンザウイルスの最も特徴的な性質は、毎年のように変異を起こすことであり、その程度により、ワクチンの効果は毎年のように変わります。変異には、「連続抗原変異」と「不連続抗原変異」があります。前者は遺伝子に大きな変化が起きているわけではないことから、ウイルス株の差によってワクチンの効果にあまり変化は見られません。しかしながら、不連続抗原変異の場合、突然変異によって遺伝子に大きな変化を伴うため人類には免疫がなく、しばしば世界的流行が起こります。この大流行は、一般的に「パンデミック」と呼ばれております。平成21年に新型インフルエンザA(H1N1)のパンデミックが起きたことは、記憶に新しい経験であります。近年H5N1をはじめとする高病原性鳥インフルエンザウイルスが出現しており、渡り鳥の感染死や家鶏への伝播が数多く報告されております。種を超えて鳥からヒトへ、さらにヒトの間で感染するようになる、致死率の高いパンデミックを起こす危険性が指摘されております。交通機関の発達した現代においてパンデミックが起こると、感染は特定地域に留まらず、極めて短期間かつ広範囲に感染者数が増加する可能性があります。したがって、流行するインフルエンザウイルスの亜型に適合したワクチンを短期間で製造し、できる限り多くのヒトに対して接種することが感染拡大予防のために重要であります。UMN-0501は、このようなパンデミック対応用の組換えインフルエンザHAワクチンであります。
当社は、平成20年6月よりUMN-0501の第Ⅰ/Ⅱ相臨床試験を開始いたしました。当該試験は、20歳から40歳の健康な男性を対象とし、1群25例計5群125例に対して接種が行われ、重篤な有害事象は観察されず安全性が確認されるとともに、アルミニウムアジュバント35)を用いずに免疫原性を確認いたしました。本成績は、平成21年2月スイス・ジュネーブにおいて開催された、世界保健機関(World Health Organization、以下、「WHO」といいます。)の高病原性鳥インフルエンザワクチン臨床試験の評価会議である「5th WHO Meeting on Evaluation of Pandemic Influenza Prototype Vaccines in Clinical Trials」にて発表いたしました。平成21年10月より実施された第Ⅱ相臨床試験において、20歳から40歳の健康な男女90名を対象として、UMN-0501の免疫原性、安全性及び臨床用量の検討を行いました。解析結果では用量依存的な免疫原性が確認され、国際的に使用されているインフルエンザワクチンの有効性の評価基準をほぼ満たしました。また、接種による忍容性は良好であり、重篤な有害事象や高度な全身反応は試験期間を通じて観察されませんでした。日本においては、アステラス製薬株式会社と共同で、平成23年8月より第Ⅱ相臨床試験を実施いたしました。当該試験は、20歳から40歳の健康な成人を対象とし、Part1は1群10例計3群30例、Part2は1群50例計3群150例に対して接種が行われ、平成24年3月に良好な免疫原性と優れた忍容性を確認しております。東アジア主要国においては、各規制当局との交渉によりますが、韓国においてはUMN-0502と同様に、日東製薬株式会社との共同開発及び独占的販売に関する契約に基づき、当社及びアステラス製薬株式会社が実施した日本での臨床試験結果を活用し、ブリッジング試験を実施する計画にしております。台湾及び中国においては、UMN-0502と同様に、國光生物科技股份有限公司に対して商業化に関する優先交渉権を供与する契約を締結しております。
③ 開発コード:UMN-0901(組換えインフルエンザHAワクチン(H9N2株))
Section titled “③ 開発コード:UMN-0901(組換えインフルエンザHAワクチン(H9N2株))”UMN-0901は、UMN-0501と同様、パンデミックインフルエンザを引き起こしうるウイルスとして懸念されている、H9N2亜型インフルエンザウイルスに対するワクチンであります。WHOはH5N1亜型だけでなく、H9N2亜型に対するワクチンの開発も推奨しております。H9N2亜型は、主にアジア・中東諸国を中心に発生しており、中国におけるヒトへの感染例や、ブタ・鳥からのウイルス検出が報告されております。本株はH3N2亜型ウイルスと遺伝子の再集合36)を起こしやすく、変異によりヒトへの感染性が強くなる可能性が高いとされております。動物における毒性は弱く、ヒトに感染しても症状が軽く見分けにくいことが予想され、伝播しやすい傾向があると考えられます。しかしながら、日本において本亜型に対するワクチンの開発は未だに行われておりません。BEVSによるH9N2亜型のHA製造については、既にPSCにおいて実績があり、当社グループでも、UMN-0502やUMN-0501と同様、BEVSを用いて製造することが可能であると考えており、現在、早期に臨床試験を開始することを目的として非臨床試験を実施中であります。また、韓国においては、UMN-0502及びUMN-0501と同様に、日東製薬株式会社との共同開発及び独占的販売に関する契約を締結しております。さらに、台湾及び中国においては、UMN-0502及びUMN-0501と同様に、國光生物科技股份有限公司に対して商業化に関する優先交渉権を供与する契約を締結しております。
④ 開発コード:UMN-2003(組換えノロウイルスVLP+組換えロタウイルスVP6混合ワクチン)、UMN-2002(組換えノロウイルスVLP単独ワクチン)
Section titled “④ 開発コード:UMN-2003(組換えノロウイルスVLP+組換えロタウイルスVP6混合ワクチン)、UMN-2002(組換えノロウイルスVLP単独ワクチン)”UMN-2003は、ノロウイルス2遺伝子型のウイルス様粒子(Virus Like Particle:VLP)とロタウイルスのウイルスタンパク(VP6)を混合した、アジュバントを含まない3価ワクチンであります。
ノロウイルス、ロタウイルスともにウイルス性胃腸炎の主要な原因ウイルスであり、本ワクチン接種により、両ウイルスへの感染を一つのワクチンで予防することが期待されます。
ノロウイルスは、ウイルス遺伝子配列の相同性によって大きく2群(GⅠ、GⅡ)に分類され、GⅠはさらに15種類の遺伝子型GⅠ-1~GⅠ-15、GⅡはさらに20種類の遺伝子型GⅡ-1~GⅡ-20に分類されます。UMN-2003は、複数の遺伝子型のノロウイルスに対して交差免疫を発揮するよう設計され、GⅠ-3とGⅡ-4のVLPを含みます。
ロタウイルスの粒子は、3層のカプシド(殻)タンパクで覆われており、中間のカプシドを構成するタンパクVP6によって群(A群~G群)が決定されます。ヒトのロタウイルス感染症の病原体としては、A群が最も一般的であることから、UMN-2003は、A群のロタウイルスから得られたVP6の組換えタンパクをワクチン抗原としております。
UMN-2003の発明者は、フィンランドのタンペレ大学ワクチン研究センターのティモ・ヴェシカリ教授、ヴェスナ・ブラゼヴィッチ博士であり、当社は、UMN-2003の全世界における独占的事業化権を許諾されております。タンペレ大学におけるマウスを用いた試験ではBEVSで製造したノロウイルスVLP とロタウイルスVP6を混合接種することで、それぞれの抗原性に干渉することなく、高い免疫原性が確認されており、現在、非臨床試験を実施中であります。
また、平成26年2月に第一三共株式会社と「ノロウイルスワクチンの共同研究契約」を締結したことに伴い、UMN-2002を開発パイプラインとして新たに設定いたしました。
毎年、全世界でノロウイルスにより約20万人、ロタウイルスでは約45万人が命を落としていると言われております(Emerg Infect Dis. 2008;Vaccine 2012)。先進国においては死に至るケースは少ないものの、医療経済的損失が甚大なためワクチンによる予防が求められておりますが、市販されたノロウイルスワクチンは未だありません。ロタウイルスに対する生ワクチンは多くの国で接種可能ですが、腸重積症を誘発する副反応の懸念が払拭できず、生ワクチンに代わる安全性の高いワクチンの開発が強く望まれると考えております。
(6)日本及び東アジアにおける組換えインフルエンザHAワクチンに関する事業提携について
Section titled “(6)日本及び東アジアにおける組換えインフルエンザHAワクチンに関する事業提携について”下記により、当社は組換えインフルエンザHAワクチンに関し、研究・開発・製造・販売の日本及び韓国におけるバリューチェーンを完成いたしました。
① 株式会社IHIとの提携について
Section titled “① 株式会社IHIとの提携について”平成22年1月、当社及び株式会社IHIは、当社が開発する日本初の組換えインフルエンザHAワクチン原薬の製造事業に関して、共同で事業運営を行う基本協定「協業に関する基本協定書」を締結いたしました。本協定に基づき、平成22年5月に組換えインフルエンザHAワクチンの原薬製造事業を目的とする株式会社UNIGENを設立し、当社連結子会社といたしました。平成22年6月に当社及び株式会社IHIと共同で増資を行い、BEVSを用いたバイオ医薬品原薬製造事業の協業活動を開始いたしました。ワクチン生産体制の構築に必要な培養技術や工業化開発などで相互に知見を蓄えており、原薬生産施設と工程の確立に関し相乗的な効果を発揮しております。株式会社UNIGENは、組換えインフルエンザHAワクチンの迅速な供給ニーズに対応するため、効率的な生産施設の運営に向けた整備を行っております。
② アピ株式会社との提携について
Section titled “② アピ株式会社との提携について”平成22年4月、当社及びアピ株式会社は、当社が開発する組換えインフルエンザHAワクチンの製剤工程業務に関して包括提携を行う「基本協定書」を締結、アピ株式会社に対して製剤工程業務を独占的に委託することを目的とする「製造委託基本契約書」を平成23年3月に締結しております。当該提携により、当社及び株式会社IHIが共同で製造する組換えインフルエンザHAワクチン原薬を、市場に供給する最終製品に仕上げることが可能となりました。市場への安定供給を可能にするため、共同で製剤開発研究を行っております。
③ アステラス製薬株式会社との提携について
Section titled “③ アステラス製薬株式会社との提携について”平成22年9月、当社及びアステラス製薬株式会社は、UMN-0502及びUMN-0501の日本における共同開発、独占販売に関し、「細胞培養インフルエンザワクチンの共同事業化契約」を締結いたしました。本契約に基づき、臨床試験はアステラス製薬株式会社が主体となって実施し、当社は臨床試験に供する治験薬をアステラス製薬株式会社に提供いたします。また、アステラス製薬株式会社が製造販売承認の申請を実施し、当社グループは製品に関する承認申請データを取得し、アステラス製薬株式会社に提供いたします。販売開始後は、当社グループがアステラス製薬株式会社に対して最終製品を供給し、アステラス製薬株式会社が独占的に販売を行います。
これら、共同事業化を進めるに当たって、当社及びアステラス製薬株式会社にて別途共同開発会議を設置し、重要な意思決定を行いながら開発を進める体制となっております。
また、当社は、提携に伴う一時金及びUMN-0502の第Ⅰ/Ⅱ相臨床試験終了に伴う開発マイルストーンペイメントを収受しており、今後もUMN-0502及びUMN-0501それぞれの開発進捗に応じてマイルストーンペイメントを収受いたします。また、UMN-0502については販売開始後に一定販売高に達した場合、その販売高に応じてマイルストーンペイメントを収受いたします。これとともに、当社はアステラス製薬株式会社に対して最終製品を合意された計算式に基づく価格にて供給し、また一定料率のランニングロイヤリティを収受いたします。
④ 日東製薬株式会社との提携について
平成24年12月、当社及び日東製薬株式会社は、UMN-0502、UMN-0501及びUMN-0901の韓国における共同開発及び独占的販売に関し、「Agreement For The Co-development And Commercialization Of Recombinant Influenza HA Vaccines In South Korea」を締結いたしました。本契約に基づき、臨床試験は、日東製薬株式会社が主体的に実施し、当社は臨床試験に供する治験薬を有償にて供給いたします。また、承認申請は日東製薬株式会社が実施いたします。販売開始後は、当社グループが日東製薬株式会社に対して原薬を供給し、日東製薬株式会社が最終製品化し、独占的に販売を行います。
また、当社は、提携に伴う一時金を収受しておりますが、今後も開発段階に応じて開発マイルストーンペイメントを収受いたします。
(7)バイオ医薬品受託製造(BCMO)事業について
当社グループは、次世代バイオ医薬品自社開発事業において整備した横浜研究所及び秋田工場、並びに岐阜工場の施設群、これら施設に従事するバイオ医薬品生産・品質管理等のノウハウに長けた人材を活用して、BCMO事業の展開を開始いたしました。
平成24年7月に、アピ株式会社とバイオ医薬品受託製造事業に関する提携契約を締結し、原薬製造及び製剤化の一貫受注体制を確立するとともに、平成24年12月には、Catalent Pharma Solutions, Inc.と抗体医薬を対象としたバイオ後続品の生産株を非独占で供給を受ける契約を締結し、受注体制の整備を図ってまいりました。
これらの活動の結果、平成25年6月に、アピ株式会社及び株式会社ヤクルト本社とがん領域における抗体バイオ後続品に関する共同事業契約を締結、同年12月に2品目についても共同事業契約を締結いたしました。
当社グループの当該事業領域における強みは、以下のとおりであります。
① 開発初期から商用生産まで顧客のあらゆるニーズに応えることが可能な生産体制を構築
② 自社開発事業を通じてGMP生産や品質管理における開発ソリューションを提供
③ 岐阜工場において、季節性インフルエンザワクチンの生産時期である3月から7月を除く
期間において受託生産を行うことによる高いコスト競争力
今後、これらの強みを生かして、単に受託に留まらず、開発的要素を有する受託事業を展開し、製品供給による収益に加えて製造に関するランニング・ロイヤリティも収受可能な事業を推進してまいります。
用語集
| 1) | Protein Sciences Corporation昭和58年に設立された米国コネチカット州メリデンにあるバイオベンチャー企業。タンパク製造技術BEVS(Baculovirus Expression Vector System ※後述)に関する特許を有しており、医薬品用タンパク製造のための施設を有し、予防ワクチン、治験薬、診断薬の研究開発及びタンパク受託生産を主な事業としている。同社の季節性組換えインフルエンザHAワクチン「Flublok®」は2013年1月FDAより18歳から49歳までを対象として承認を取得し、販売を開始している。 |
|---|---|
| 2) | BEVS(Baculovirus Expression Vector System)当社グループの開発パイプラインの製造プラットフォームとなる基盤技術。「3 事業の内容 (3)当社グループの製造プラットフォームについて ① BEVSとは」にて詳細を記載しております。 |
| 3) | 組換えある種の成分を生産することを目的として、その成分の基となる遺伝子配列を違う種類の生物の遺伝子配列に組み込むこと。 |
| 4) | HA(Hemagglutinin ヘムアグルチニン)in vitroにて赤血球の凝集体を作らせる働きを有する糖タンパクで、インフルエンザをはじめとするウイルスや細菌等の表面に存在する。ウイルスは、ヘムアグルチニンの働きにより、細胞に感染する。HA1とHA2からなるモノマー(単量体)がトリマー(三量体)を形成する構造をとる。 |
| 5) | 多価医薬品の有効成分が、2つ以上含まれるものをいう。 |
| 6) | H5N1A型インフルエンザウイルス表面には、ヘムアグルチニン(HA)とノイラミニダーゼ(NA、下記32)参照)があり、インフルエンザウイルスはHAとNAの種類によってHとNの番号が付される。A型インフルエンザウイルスにおいては、HAが少なくとも16種類(H1~H16)、NAは9種類(N1~N9)存在している。H5N1は、H5とN1の組み合わせをもつウイルス株であることをいう。 |
| 7) | 原薬医薬品の成分のなかで、目的とする効果を示す化学成分のことで、医薬品の有効成分といわれるもの。 |
| 8) | H9N26)に記載するH5N1と同様に、H9とN2の組み合わせをもつウイルス株であることをいう。 |
| 9) | VLP(Virus Like Particle)ウイルスの外殻のみを持ち、内部にはウイルスゲノムを持たない中空のウイルス様粒子のこと。ウイルスゲノムを持たないことから宿主内で増殖できないが、外殻に対する抗体産生を誘導する。VLPは、組換えタンパクの単一分子と比べはるかに大きく、樹状細胞やマクロファージなどの抗原提示細胞に病原体の如く貪食されやすいため、アジュバントなしで強力な免疫を誘導する抗原として期待されている。世界で広く使用されているヒトパピローマウイルスワクチン「サーバリックス®」はBEVSで製造されたVLPワクチンである。 |
| 10) | ロタウイルスVP6当社が開発中のロタウイルスに対するワクチンの成分。「3 事業の内容 (5)当社の開発パイプライン ④ 開発コード:UMN-2003(組換えノロウイルスVLP+組換えロタウイルスVP6混合ワクチン)、UMN-2002(組換えノロウイルスVLP単独ワクチン)」に詳細を記載しております。 |
| 11) | 希少疾病用医薬品(オーファンドラッグ)薬事法第77条の2に基づき、対象患者数が本邦において5万人未満であること、医療上特にその必要性が高いものなどの条件に合致するものとして、薬事・食品衛生審議会の意見を聴いて厚生労働大臣が指定するものである。 |
| 12) | ブースター追加免疫効果のこと。体内で一度獲得された免疫機能が、再度抗原を接種することにより、更に免疫機能が高まることをいう。 |
| 13) | 免疫原性生体に投与した時、抗体の産生をもたらす性質のこと。通常、細菌やウイルスなどの外来病原体や人為的な注射などで体内に入るタンパク質がこのような性質をもつ。 |
| 14) | 忍容性医薬品を投与した場合、明白な有害作用(副作用)が被験者にとってどれだけ耐えうるかの程度を示す。忍容性が高いとは、全身性・局所性の副反応が少なく、与薬の継続に支障をきたさないことを意味する。 |
|---|---|
| 15) | 製造プラットフォーム当社グループの重要な事業の一つは製造であります。BEVSは、ワクチン等の医薬品の製造技術であり、当社の製造面を支えるプラットフォーム技術と位置付けております。 |
| 16) | アジュバントワクチンなどの抗原と一緒に注射され、その抗原性を増強するために用いられる薬品のこと。 |
| 17) | 製造設備バリデーション製造所の構造設備並びに手順、工程その他の製造管理及び品質管理の方法が期待されている結果を与えることを検証し、これを文章化することをいう。 |
| 18) | リード化合物最終的な医薬品を導出する出発点となる化合物。生理活性を有し、その化学構造は医薬品としての有効性や薬物動態における要素を改良していくための始発点となる。開発を進めるために、化学構造を改良する必要がある。 |
| 19) | 化学修飾ある物質に化学反応によって新しい原子団などを結合させること。低分子医薬品の場合、有効性の向上、安定性の向上、副作用の軽減等を目的として、様々な化学修飾の検討を経て候補化合物が決定される。 |
| 20) | 信頼性基準薬事法施行規則第43条に定められる「申請資料の信頼性の基準」をいう。 |
| 21) | 物性試験医薬品候補物質の構造、物理的・化学的性質、安定性、品質などを検証し、医薬品としての規格を決定することを目的とした試験。 |
| 22) | 薬物動態試験医薬品候補物質及びその代謝物の吸収・分布・代謝・排泄といった体内動態を検討し、安全域を推測するとともに、ヒトでの投与量や回数を推定することを目的とした試験。 |
| 23) | 単回毒性試験医薬品候補物質を単回投与し、その毒性を質的量的側面から明らかにすること。 |
| 24) | 反復毒性試験医薬品候補物質を複数回投与し、毒性変化を示す量、毒性の内容、及び安全域を明らかにすること。 |
| 25) | がん原性試験医薬品候補物質ががんを引き起こす要因になるかどうかを明らかにすること。 |
| 26) | 変異原性試験生物の遺伝情報(DNAあるいは染色体)に変化を引き起こす作用を有する物質または物理的作用(放射線など)の性質あるいは作用の強さを明らかにすること。 |
| 27) | 偽薬(プラセボ)真の医薬品と外見上は全く一緒であるが、医薬品としての有効成分が一切入っていない偽物の薬をいう。 |
| 28) | 二重盲検比較試験被験者に割り付けられた治験薬(被験薬あるいは偽薬)を、被験者だけでなく、医師を含む治験実施スタッフや治験依頼者も知らないように進める試験(Double Blind Study)。統計的にデータの信頼性を担保するための医薬品の臨床試験デザインの一つである。 |
| 29) | バキュロウイルス(Baculovirus)核多角体病ウイルス(NPV)と顆粒病ウイルス(GV)の2属に分けられるDNAウイルス。ビリオン(細胞外に存在し、感染性を有する完全なウイルス粒子)は大型の棒状をしている。種特異性が高く、節足動物(大部分はチョウ目の幼虫)に感染する。ヒトの細胞では感染増殖をしない。ヒトを含む哺乳動物に対しては病原性がなく安全である。 |
| 30) | 株化長期間にわたって、生体外で維持され、一定の安定した性質を有する状態に至った細胞を細胞株という。株化した細胞は、継代培養が可能となる。 |
| 31) | 馴化(じゅんか)高病原性鳥インフルエンザウイルスは、鳥類の細胞に強い毒性を持つため、ワクチン製造に際し孵化鶏卵に感染させると胚が死んでウイルスが増殖しない。また、毒性の強くないインフルエンザウイルスであっても、鶏卵内での増殖が遅くワクチン製造に支障が出る場合がある。これらの場合に、ウイルスを孵化鶏卵にて迅速に増殖できるよう適応させることを馴化と呼ぶ。 |
|---|---|
| 32) | H7N9用語集6)H5N1、8)H9N2と同様に、H7とN9の組み合わせをもつウイルス株であることをいう。 |
| 33) | ノイラミニダーゼ(Neuraminidase :NA)動物の種々の臓器、微生物、ウイルスに存在する酵素で、シアル酸を糖タンパクや糖脂質から切り離す作用を有する。インフルエンザウイルスのもつノイラミニダーゼは、ウイルス表面にあるHAと宿主細胞表面のシアル酸の結合を切断することで、ウイルスが細胞外に放出され増殖することが可能となる。 |
| 34) | 治験薬GMP製造販売承認前に実施する治験において使用されるサンプルを製造する場合に適用されるGMP省令をいう。 |
| 35) | アルミニウムアジュバント用語集16)アジュバントのうち、水酸化アルミニウム(Alum)を用いたもの。一般的に、Alumの添加によりワクチンによる効果のみならず副反応も増加する。 |
| 36) | 遺伝子の再集合異なる2種類のインフルエンザウイルスが混合感染した時に、感染細胞内で遺伝子分節(A型インフルエンザウイルスは8種類のRNA遺伝子分節から成る)が様々な組合せで再集合(遺伝子再集合,reassortment)をおこし、別の組み合わせの遺伝子をもった遺伝子再集合体(reassortant)が出現すること。 |
4 【関係会社の状況】
Section titled “4 【関係会社の状況】”平成25年12月31日現在
| 名称 | 住所 | 資本金 (千円) | 主要な事業の内容 | 議決権の所有[被所有]割合(%) | 関係内容 |
|---|---|---|---|---|---|
| (連結子会社) | |||||
| 株式会社UNIGEN | 秋田県秋田市 | 1,500,500 | 医療用医薬品原薬の製造・販売 | 50.00 | 設備の賃貸借従業員の出向及び出向受入役員の兼任 2名医薬品製造の委託資金の貸付債務保証被債務保証増資の引受 |
(注) 特定子会社であります。
5 【従業員の状況】
Section titled “5 【従業員の状況】”(1)連結会社の状況
Section titled “(1)連結会社の状況”当社グループの事業は、医療用医薬品事業並びにこれらの付帯事業の単一事業であるため、以下に関しては当社及び連結子会社に分類し、記載いたします。
平成25年12月31日現在
| 会社名 | 従業員数(名) |
|---|---|
| 当社 | 29 |
| 株式会社UNIGEN | 62 |
| 合計 | 91 |
(注) 従業員数は就業人員(当社グループから当社グループ外への出向者を除き、当社グループ外から当社グループへの出向者を含む。)であります。
(2)提出会社の状況
Section titled “(2)提出会社の状況”平成25年12月31日現在
| 従業員数(名) | 平均年齢(歳) | 平均勤続年数(年) | 平均年間給与(千円) |
|---|---|---|---|
| 29 | 38.9 | 2.8 | 4,990 |
(注) 1.従業員数は就業人員(当社から社外への出向者を除き、社外から当社への出向者を含む。)であります。
2.平均年間給与は、基準外賃金を含んでおります。
3.当社は、単一事業であるため、セグメントに関連付けた記載を省略しております。
(3)労働組合の状況
Section titled “(3)労働組合の状況”労働組合は結成されておりませんが、労使関係は円満に推移しております。
第2 【事業の状況】
Section titled “第2 【事業の状況】”1 【業績等の概要】
Section titled “1 【業績等の概要】”当連結会計年度における我が国経済は、政権交代以後、大胆な金融緩和策と新政権による経済政策への期待などから円安及び株価の上昇などが見られたものの、欧州の債務問題、米国政府機関の一部閉鎖問題や世界経済の減速等の不安要素は解消されておらず、不透明な状況で推移いたしました。
我が国医薬品業界においては、医療費抑制策により医療用医薬品市場の伸びが鈍化しており、グローバル医薬品開発による世界市場での展開が一層重要になっております。
このような環境の中にあって、当社グループは、アステラス製薬株式会社と提携した「UMN-0502」(組換えインフルエンザHAワクチン(多価)、以下、「UMN-0502」といいます。)、「UMN-0501」(組換えインフルエンザHAワクチン(H5N1)、以下、「UMN-0501」といいます。)、世界保健機関(World Health Organization:WHO)がH5N1とともにパンデミック発生の可能性を指摘しているH9N2亜型に対する「UMN-0901」(組換えインフルエンザHAワクチン(H9N2)、以下、「UMN-0901」といいます。)及びウイルス性胃腸炎の主な原因ウイルスであるノロウイルス及びロタウイルスに対する「UMN-2003」(組換えノロウイルスVLP+組換えロタウイルスVP6混合ワクチン、以下「UMN-2003」といいます。)の開発に経営資源を重点的に配分し研究開発を進めてまいりました。
UMN-0502については、平成25年1月に技術導入元である米国のProtein Sciences Corporation(以下、「PSC」といいます。)の季節性組換えインフルエンザHAワクチン「Flublok®」が、米国食品医薬品局(Food and Drug Administration、以下、「FDA」といいます。)より18歳から49歳までを対象として承認を取得し、販売を開始いたしました。米国での承認により、韓国の日東製薬株式会社との契約に基づき、マイルストーンペイメントを収受いたしました。また、アステラス製薬株式会社が、国内において実施した65歳以上高齢被験者1,060例を対象とした皮下接種での第Ⅲ相臨床試験にて、国内既承認孵化鶏卵ワクチンと免疫原性及び安全性について比較検討した結果、UMN-0502は国内既承認孵化鶏卵にワクチンに対し、主要評価項目である免疫原性における非劣性基準を満たすとともに、安全性に大きな問題がないことを確認いたしました。この結果を受けて、20歳から65歳未満の健康成人被験者900例を対象とした皮下接種でのUMN-0502と国内既承認孵化鶏卵ワクチンの免疫原性及び安全性を比較することを目的とする第Ⅲ相臨床試験及び61歳以上健康成人被験者55例を対象とした筋肉内接種での免疫原性及び安全性を確認することを目的とする第Ⅲ相臨床試験を開始、平成25年10月に全例への治験薬接種を完了し、当該2試験に関し、20歳から65歳未満の健康成人被験者を対象とするUMN-0502と国内既承認孵化鶏卵ワクチンとの比較においては、高齢者と同様に主要評価項目である免疫原性における非劣性基準を満たすとともに、安全性に大きな問題がないことを確認しております。また、61歳以上健康成人被験者を対象とする筋肉内接種試験においても、良好な免疫原性及び安全性に大きな問題がないことを確認しております。事業提携面においては、東アジア地域への展開を積極的に進めた結果、平成25年10月に、台湾の國光生物科技股份有限公司とUMN-0502、UMN-0501及びUMN-0901の台湾及び中国における商業化に関する優先交渉権を供与する正式契約を締結いたしました。また、UMN-2003については、横浜研究所にて原薬製造プロセスを確立するに至りました。
生産施設については、当社連結子会社である株式会社UNIGENが、平成24年2月に経済産業省「平成23年度国内立地推進事業費補助金」一次公募対象事業に採択され、同年3月より岐阜県揖斐郡池田町にて建設を開始した組換えインフルエンザHAワクチン原薬実生産施設及びバイオ医薬品原薬生産施設である岐阜工場(以下、「岐阜工場」といいます。)が、平成25年5月に竣工いたしました。その後、21,000L主培養槽を用いたUMN-0502原薬の試験製造を実施し、商用生産スケールでの一定量のHAタンパクの精製が可能なことを確認、承認申請に必要な各種データを取得することを目的とした性能適格性評価(Performance Qualification:PQ)を開始いたしました。また、平成25年12月には、当社連結子会社である株式会社UNIGENが岐阜工場について「岐阜県企業立地促進事業補助金」より500,000千円の交付決定を受けました。
新たな事業収益の柱とすべくアピ株式会社と推進しているバイオ医薬品受託製造(Biopharmaceutical contract manufacturing organization:BCMO)事業においては、平成25年3月に締結したアピ株式会社及び株式会社ヤクルト本社とのがん領域における複数の抗体バイオ後続品の研究開発及び商業化を共同で実施すること、及びその基本事項について合意した意図契約書に基づき、平成25年6月及び同年12月に抗体バイオ後続品に関する共同事業契約をそれぞれ締結いたしました。また、国立感染症研究所などから当社独自の製造プラットフォームBaculovirus Expression Vector System(以下、「BEVS」といいます。)を用いた複数の新規ワクチン候補抗原の試験製造を受託するに至りました。
以上の結果、当連結会計期間における売上高は93,379千円(前年同期比13.7%減)となりました。一方、提携先との各開発パイプラインの研究開発、岐阜工場への設備投資及び試製造を積極的に進めたことにより、営業損失は4,421,977千円(前連結会計年度の営業損失2,072,550千円)、経常損失は4,147,960千円(前連結会計年度の経常損失2,652,395千円)、当期純損失は3,717,117千円(前連結会計年度の当期純損失1,996,917千円)となりました。
なお、当社グループは、医療用医薬品の研究開発及びこれに関連する事業の単一セグメントであるため、セグメント別の業績に関する記載を省略しております。
(2)キャッシュ・フローの状況
Section titled “(2)キャッシュ・フローの状況”当連結会計期間末における現金及び現金同等物は、前連結会計年度末に比べ384,714千円増加し、4,267,657千円となりました。
(営業活動によるキャッシュ・フロー)
営業活動により支出した資金は、3,578,459千円(前年同期は1,188,134千円の支出)となりました。その主な内訳は、税金等調整前当期純損失4,140,486千円、減価償却費1,404,400千円、利息の支払額227,539千円、助成金の受取額204,264千円であります。
(投資活動によるキャッシュ・フロー)
投資活動により支出した資金は、4,150,619千円(前年同期は8,741,491千円の支出)となりました。その主な内訳は、有形固定資産の取得による支出3,894,139千円、無形固定資産の取得による支出425,671千円であります。
(財務活動によるキャッシュ・フロー)
財務活動により獲得した資金は、8,113,793千円(前年同期は12,360,998千円の獲得)となりました。その主な内訳は、短期借入れによる収入3,386,400千円、短期借入金の返済による支出1,950,000千円、長期借入れによる収入3,025,000千円、株式の発行による収入3,599,274千円であります。
2 【生産、受注及び販売の状況】
Section titled “2 【生産、受注及び販売の状況】”(1)生産実績
Section titled “(1)生産実績”当社グループは、研究開発を主体としており、現時点においては生産活動を行っていないため、生産実績の記載はしておりません。
(2)受注実績
Section titled “(2)受注実績”当社グループは現時点において受注生産を行っておりませんので、受注実績の記載はしておりません。
(3)販売実績
Section titled “(3)販売実績”第9期連結会計年度及び第10期連結会計年度における販売実績を示すと、次のとおりであります。
| 第9期連結会計年度(自 平成24年1月1日至 平成24年12月31日) | 第10期連結会計年度(自 平成25年1月1日至 平成25年12月31日) | ||
| 販売高(千円) | 前年同期比(%) | 販売高(千円) | 前年同期比(%) |
| 108,225 | 10.8 | 93,379 | 86.3 |
(注) 1.第9期連結会計年度及び第10期連結会計年度における主な相手先別の販売実績及び当該販売実績の総販売実績に対する割合は、次のとおりであります。
| 相手先 | 第9期連結会計年度(自 平成24年1月1日至 平成24年12月31日) | 第10期連結会計年度(自 平成25年1月1日至 平成25年12月31日) | ||
| 販売高(千円) | 割合(%) | 販売高(千円) | 割合(%) | |
| 日東製薬株式会社 | 108,225 | 100.0 | 22,167 | 23.7 |
| 國光生物科技股份有限公司 | ― | ― | 50,000 | 53.6 |
2. 上記の金額には、消費税等は含まれておりません。
3. 当社グループは、単一事業であるため、セグメントに関連付けた記載を省略しております。
3 【対処すべき課題】
Section titled “3 【対処すべき課題】”(1)当社グループの特徴と現状の認識について
Section titled “(1)当社グループの特徴と現状の認識について”当社グループは、次世代バイオ医薬品の自社開発機能のみならず、製造プラットフォームを有するバイオファーマ企業としてバイオテクノロジー関連技術・製品の開発を行うとともに、日本国内において組換えインフルエンザHAワクチン原薬生産施設の整備に取り組んでおります。また、平成24年6月より各生産施設を活用したバイオ医薬品受託製造事業の展開を図っております。
現在、展開を図っている次世代バイオ医薬品自社開発事業においては、「既存パイプラインの確実な推進」、「組換えインフルエンザHAワクチンをはじめとするバイオ医薬品原薬生産体制の整備」、「UMN-0502、UMN-0501及びUMN-0901の東アジア地域への展開」、「基盤技術を活かした新規開発パイプラインの拡充」、「バイオ医薬品受託製造(BCMO)事業の積極的な展開」に経営資源を集中し、事業展開を行うことが重要であると考えております。医薬品の研究開発や生産施設の整備においては、様々なリスクが存在しており、そのため研究開発体制の強化、GMPに準拠した組換えインフルエンザHAワクチンをはじめとするバイオ医薬品原薬生産体制の整備を積極的に実施する必要があります。
今後の主要事業のひとつとして展開するバイオ医薬品受託製造事業においては、研究開発初期から商用生産まであらゆる顧客ニーズに対応可能な体制を整備するとともに、顧客が要求する品質基準を満たすサービスを提供すべく、人材の教育訓練を継続的に行っていくことが重要であると考えております。これらの課題を達成し、当社グループの事業目的を実現するためには、人材・研究開発・施設への先行投資が必要であり、それを支える収益基盤の確立及び財務基盤の強化が重要であると考えております。また、経営の質を高めるために、内部統制システムの強化やIR活動の推進も重要な課題であると認識しております。
上述のとおり、当社グループは、経営基盤をより一層強固なものにし、企業価値を最大化するために、対処すべき当面の課題を以下のように考え、各対応策の実行に努めてまいります。
(2)対処すべき当面の課題の内容及び具体的な取組状況
Section titled “(2)対処すべき当面の課題の内容及び具体的な取組状況”① 既存パイプラインの確実な推進
Section titled “① 既存パイプラインの確実な推進”当社グループの収益基盤を確立するためには、現在実行中の組換えインフルエンザHAワクチンの開発を確実に進め、事業化することが直近の最も重要な課題であると考えております。
当社は、アステラス製薬株式会社との「細胞培養インフルエンザワクチンの共同事業契約書」に基づき、UMN-0502及びUMN-0501の共同開発を確実に推進してまいります。特にUMN-0502については、承認申請準備段階にあることから、承認申請及び販売に至るスケジュールを遵守するため、経営資源を優先的に配分してまいります。
当社は、アステラス製薬株式会社との役割分担に従い、臨床試験に用いる治験薬の提供をはじめとして、主に化学・製造および品質管理(Chemistry, Manufacturing and Control、以下、「CMC」といいます。)関連業務を遂行いたします。また、これら2つのパイプラインを確実に推進するため、特にCMC関連の研究開発を担当する人材を積極的に確保していく方針であります。
UMN-0901につきましては、早期に臨床試験を開始すべく非臨床試験を着実に推進し、UMN-2003ついては、非臨床試験に向けた基礎研究を積極的に実施してまいります。
また、韓国においても、日東製薬株式会社との「Agreement For The Co-development And Commercialization Of Recombinant Influenza HA Vaccines In South Korea」に基づき、国内と同様に、UMN-0502、UMN-0501及びUMN-0901の共同開発を推進すべく、スムーズな治験薬の供給等を行ってまいります。
② 組換えインフルエンザHAワクチンをはじめとするバイオ医薬品原薬生産体制の整備
Section titled “② 組換えインフルエンザHAワクチンをはじめとするバイオ医薬品原薬生産体制の整備”日本国内でワクチン事業を展開するためには、国内における生産体制の整備が課題となります。当社は、厚生労働省「新型インフルエンザワクチン開発・生産体制整備臨時特例交付金」交付事業(第一次分)の助成金にて、秋田県秋田市に秋田工場を建設いたしました。既に性能適格性評価(Performance Qualification:PQ)を実施、今後は臨床試験に供する治験薬を供給する拠点として活用してまいります。また、当社連結子会社である株式会社UNIGENが、岐阜県揖斐郡池田町にUMN-0502をはじめとするバイオ医薬品原薬を商用生産すべく岐阜工場を建設し、生産施設の整備を実施しております。
これら原薬生産施設の運営は、株式会社UNIGENが行いますが、GMPに準拠した工場運営に係る体制構築・人材の教育訓練・業許可取得及び工場稼働率の維持・向上に留意していく必要があります。
当社グループは、秋田工場や岐阜工場の運転資金の確保のみならず、岐阜工場の立ち上げ及び本格稼働に向けた人材確保・生産体制の構築等を積極的に行ってまいります。
③ UMN-0502、UMN-0501及びUMN-0901の東アジア地域への展開
Section titled “③ UMN-0502、UMN-0501及びUMN-0901の東アジア地域への展開”当社は日本のみならず、中国・韓国・台湾・香港・シンガポールにおける組換えインフルエンザHAワクチンの独占的事業化権を有しております。既に韓国においては、平成24年12月に日東製薬株式会社と共同開発及び独占的販売権について契約、また、台湾及び中国においては、平成25年10月に國光生物科技股份有限公司とUMN-0502、UMN-0501及びUMN-0901の同地域における商業化に関する優先交渉権を供与する契約を締結しております。これらの地域においては高成長が期待されており、当社グループの成長をさらに加速するためには、これらの地域への展開が重要な課題となります。各国の製造・開発・承認・販売に係る規制環境に合わせ、ライセンスアウト、合弁会社設立または日本からの輸出等、各国のビジネス環境に合致した最適の手段を選択し、積極的に事業展開を行ってまいります。
④ 基盤技術を活かした新規開発パイプラインの拡充
Section titled “④ 基盤技術を活かした新規開発パイプラインの拡充”当社グループの企業価値を持続的に向上させていくためには、新規開発パイプラインを拡充することにより、医薬品開発におけるリスク分散と将来の収益機会の確保が重要であると考えております。当社が保有する独自の製造プラットフォームであるBEVSには、多種多様なタンパクを製造できるという特徴を有することから、既存の開発パイプラインのみならず、その他のワクチン、さらにはタンパク製剤への応用展開が可能であります。
当社グループの役職員には、国内外の大手製薬企業での豊富な経験と実績を有する人材が複数おり、大学をはじめとする各種研究機関との広範な人的ネットワークを有しております。新たなパイプラインを開始するにあたり、このような人的ネットワークを介していち早く有望なワクチンやタンパク製剤を中心とした新薬の情報を得るのみならず、開発の可能性及び懸念されるリスク等の分析・評価に関する精度を高め、より価値の高いパイプラインを確保することが、結果として当社の企業価値向上をもたらすものであると考え、今後も研究開発を担当する優秀な人材を積極的に獲得してまいります。
⑤ バイオ医薬品受託製造(BCMO)事業の積極的な展開
Section titled “⑤ バイオ医薬品受託製造(BCMO)事業の積極的な展開”バイオ医薬品受託製造事業は、当社グループの各原薬生産施設・人材・製造に関する知見を活用した事業であります。平成24年7月にアピ株式会社と、バイオ医薬品受託製造事業の協業に関する契約を締結、また同年12月にCatalent Pharma Solutions,Inc.より、バイオ後続品生産細胞株を非独占にて提供を受ける契約を締結し、マーケティング活動を開始いたしました。平成25年6月及び同年12月には、アピ株式会社及び株式会社ヤクルト本社と複数のがん領域における抗体バイオ後続品の共同事業契約を締結し、バイオ後続品の事業化を開始いたしました。また、複数の機関より新規バイオ医薬品候補品の原薬についての製造受託を獲得するなど着実に受託実績を積み重ねております。
平成24年における世界の医薬売上上位10位のうち7品目がバイオ医薬品であり(出所:セジテム・ストラテジックデータ株式会社「世界の大型医薬品売上高ランキング」より)、70%を占めるまでに成長しております。今後、バイオ医薬品開発に積極的に取り組む企業が増加するため、バイオ医薬品生産量は一層増加していくものと想定されます。一方、バイオ医薬品の特許有効期間が過ぎれば、バイオ後続品が順次市場に投入されることになります。確立された生産体制を比較的容易に得ることができること、生産施設保有リスクを低減できること、研究開発に特化することで経営資源の集中化ができること、製造に関する蓄積されたノウハウを活用することによりコストの低減が見込めることから、バイオ後続品市場への参入を考えている企業が、バイオ医薬品受託製造企業へ製造を委託する事例が今後増えると考えられます。
当社グループは、最先端のバイオ医薬品生産施設、高度なバイオ医薬品製造ノウハウをもった人材、自社開発品の生産プロセスの開発経験に基づく提案力を自社の強みとしており、アピ株式会社の営業ルートを通じて、今後成長が見込まれるバイオ医薬品受託製造事業に進出することを決定いたしました。
一方、バイオ医薬品受託製造事業において想定されうる顧客ニーズは、極めて多岐にわたることから、受託体制の整備を積極的に行うとともに、当社グループが実施する受託業務の信頼性を確保していく体制を拡充していく必要があります。また、顧客が要求する基準以上の品質を保つことを第一義とする受託業務を行うにあたり、優秀な人材のさらなる確保、継続的な教育訓練を実施することによる組織力の向上を図ってまいります。
⑥ 財務基盤の強化
Section titled “⑥ 財務基盤の強化”当社グループは、既存パイプラインの開発の推進、組換えインフルエンザHAワクチンをはじめとするバイオ医薬品原薬生産施設の整備、新規開発パイプラインの拡充、バイオ医薬品受託製造事業における追加設備投資、人材の確保や教育訓練等、事業活動に必要な資金を継続的に外部より調達する必要があります。
これまで当社グループでは、研究開発に係る資金につきましては、事業会社との戦略的提携や製薬企業との共同事業に伴う権利許諾への対価、第三者割当増資、上場に際しての公募調達、新株予約権の発行等により資金を調達してまいりました。また、岐阜工場の建設資金に充当することを目的として、当社連結子会社である株式会社UNIGENにおいて、株式会社三井住友銀行をアレンジャーとし、平成24年2月に総額10,500,000千円のシンジケートローン契約を金融機関等10社と、また同年9月には、2,500,000千円のシンジケートローン契約を金融機関等4社とそれぞれ締結し、設備資金を調達してまいりました。今後も財務基盤強化のために、製薬企業等との提携による開発協力金の確保や金融機関等を通じた資金調達の可能性等を適時検討してまいります。
⑦ 内部統制システムの強化
Section titled “⑦ 内部統制システムの強化”当社グループは、業務の有効性・効率性を高め、財務報告の信頼性を確保し、事業活動に関わる法令等の遵守を促進し、資産の保全を図るため、内部統制システムを維持してまいります。また、リスク管理・コンプライアンス体制等の充実により、内部管理体制のより一層の強化を目指してまいります。
⑧ IR活動の推進
Section titled “⑧ IR活動の推進”当社グループは、株主・投資家等の当社のステークホルダーと双方向のコミュニケーションを重視し、経営の一層の改善に役立てるために、企業情報を正確、公平かつ適時・適切に発信するよう努め、信頼と正当な評価を得ることを目指してまいります。
4 【事業等のリスク】
Section titled “4 【事業等のリスク】”以下に、当社グループの事業その他に関して、リスク要因と考えられる主な事項を記載いたしております。また、当社として必ずしも重要とは考えていない事項についても、投資判断のうえで、あるいは当社の事業活動を理解するうえで重要と考えられる事項については、積極的に開示しております。当社といたしましては、以下のようなリスク事項が現実のものとして発生する可能性を十分に認識したうえで、経営の安定性の観点から、発生の回避及び発生した場合の迅速な対応と影響の最小化に最大限努める方針でありますが、当社株式に関する投資判断は、以下の事項及び本項記載以外の記載事項を慎重に検討したうえで行われる必要があると考えております。また、以下の記載は当社株式への投資に関する全リスクを網羅したものではないことにご留意いただく必要があります。
なお、文中における将来に関する事項は、本有価証券報告書提出日現在において当社が判断したものであります。
(1)医薬品開発に関する一般的なリスク
Section titled “(1)医薬品開発に関する一般的なリスク”① 医薬品開発の不確実性について
Section titled “① 医薬品開発の不確実性について”当社グループは、医薬品開発及び製造を主業務としております。一般的に、医薬品の研究開発期間は、基礎研究段階から承認取得に至るまで長期間を要し、相当規模の研究開発投資が必要と考えられます。さらに、その成功の可能性は、他産業に比して極めて低いものとされております。当社グループの提携済みパイプライン及び開発パイプラインのうち、UMN-0502については、アステラス製薬株式会社が実施した第Ⅲ相臨床試験にて良好な免疫原性と安全性に大きな問題がないことを確認しております。しかしながら、承認申請準備段階にあるものの上市に至っておりません。その他の開発パイプラインについては開発途中であり、様々な開発リスクが存在しております。したがって、当社グループの提携済みパイプラインは、医薬品として上市に至るかどうかは不確定であり、新規開発パイプラインについても想定どおりに開発が進められるとは限りません。これらの不確実性は当社の財務状態及び経営成績に重大な影響を及ぼす可能性があります。
② ワクチン販売予測の不確実性について
Section titled “② ワクチン販売予測の不確実性について”現在、インフルエンザワクチンの需要は、高齢化の進行、予防医療に対する意識の向上、行政のサポートなどにより、継続的に伸長していくと想定されております。しかしながら、患者数が予測可能で使用対象が比較的明らかな治療薬と異なり、季節ごと、国と地域ごとに流行状況が異なること等により、インフルエンザワクチンの需要には、様々な不確実要素が存在いたします。UMN-2003は、同効のワクチンが市場に存在しないノロウイルス及び生ワクチンからの切り替えが必要なロタウイルスワクチンの混合ワクチンであること、UMN-2002は、同効のワクチンが市場に存在しないノロウイルス単独ワクチンであること、販売する国と地域が将来の販売パートナーに依存することなど、需要予測には、様々な不確実要素が存在いたします。また、予期されない副反応などにより、ワクチンの安全性、有効性に疑念が生じることによって、需要が減退し、当社グループの事業戦略及び経営成績に重大な影響を与える可能性があります。
③ ワクチンの返品に関する製造業者負担について
Section titled “③ ワクチンの返品に関する製造業者負担について”日本におけるワクチン販売においては、返品は製造業者が引き取る商習慣となっております。返品を最小化するべく、需要予測を正確に見積もる努力をするものの、それぞれの医療機関の需要予測が大きく外れた場合、需要と供給のバランスが崩れ、ワクチンが偏在することによる返品が生じる結果、返品に係る引当金を一定額計上することになります。返品割合が多く見積もられる場合、当社グループの将来の利益が減少する可能性があります。
④ ワクチン出荷までのリードタイムの長さについて
Section titled “④ ワクチン出荷までのリードタイムの長さについて”日本において、季節性インフルエンザワクチンは、国家検定というプロセスを経るため、製造から出荷までのリードタイムが約2ヵ月間と通常の医薬品に比べ長くなっており、かつ、販売期間は約3ヵ月間に限られるため、需要が急速に高まった場合、供給が追い付くまでに時間がかかり、需給ギャップが生じやすく、供給過剰による返品または供給過少による欠品により、経営成績に重大な影響を与える可能性があります。
(2)当社事業遂行上のリスク
Section titled “(2)当社事業遂行上のリスク”① PSCからの技術導入契約における契約解除の可能性について
Section titled “① PSCからの技術導入契約における契約解除の可能性について”平成18年8月に締結したPSCとの日本における独占的ワクチン開発、製造及び販売権に係る契約において、契約解除条項は、以下のとおりとなっております。
a 一方に重大な契約違反があった場合、90日前までの通知で他方が解約できる。
b 当社は、90日前までの書面による通知でいつでも契約を終了させることができる。
この他に契約解除条項は付されておりませんので、当該条項に該当する事案が発生する可能性は極めて低いと考えておりますが、何らかの理由により当該条項に抵触した結果、契約が解除された場合、当社グループの中心的事業である組換えインフルエンザHAワクチン事業を中止せざるを得なくなる可能性があります。事業中止に伴い、アステラス製薬株式会社との提携が解消され、事業継続が困難になるのみならず、生産設備の除却等が発生する場合、多大な費用を計上することになり、当社グループの事業存続に大きな影響を与える可能性があります。
② 特定の製薬企業との提携契約への依存について
Section titled “② 特定の製薬企業との提携契約への依存について”当社グループが現時点で有している製薬企業との販売提携契約は、アステラス製薬株式会社と平成22年9月に締結したUMN-0502及びUMN-0501に関する「細胞培養インフルエンザワクチンの共同事業契約書」、日東製薬株式会社と平成24年12月に締結したUMN-0502、UMN-0501及びUMN-0901に関する「Agreement For The Co-development And Commercialization Of Recombinant Influenza HA Vaccines In South Korea」、バイオ医薬品受託製造事業については、アピ株式会社及び株式会社ヤクルト本社と平成25年6月及び同年12月に締結した「がん領域における抗体バイオ後続品に関する共同事業契約」のみであります。これらの契約が解除その他の理由で終了した場合や、同契約で予定されている開発や販売活動の全部または一部が何らかの理由で停止した場合には、当社グループの事業戦略及び経営成績に重大な影響を及ぼす可能性があります。
また、同契約に基づく事業活動に関する提携先の経営判断が当社グループにとって合理的と言えないものであるなど、当社の想定と異なった場合には、当社グループの希望どおりの事業活動ができない、もしくは制約を受ける可能性があり、結果として、当社グループの事業戦略や経営成績に重大な影響を及ぼす可能性があります。
さらに、提携先企業が実施する臨床試験及び承認申請の結果が、当社グループの事業戦略及び経営成績に重大な影響を及ぼします。当社グループとしては、提携先企業をサポートし、臨床試験を成功させ承認を得ることを目標とするものの、当社グループのコントロールできない何らかの事情により、承認申請の時期が遅延する、審査期間が想定より長期化する、もしくは承認されない可能性があり、結果として、当社グループの事業戦略や経営成績に重大な影響を及ぼす可能性があります。
加えて、今後の当社の販売計画は提携先企業の販売計画に依存しており、当社グループのコントロールできない何らかの事情により、同社の経営方針や販売計画の変更、経営環境の悪化等により販売計画を達成できない等の可能性があります。
③ 株式会社IHIとの提携契約への依存について
Section titled “③ 株式会社IHIとの提携契約への依存について”当社は、組換えインフルエンザHAワクチン原薬製造事業を株式会社IHIと共同で行う「協業に関する基本協定書」、「基本協定書の変更に関する覚書」及び「基本協定書の変更に関する覚書の修正覚書」を、それぞれ平成22年1月、平成24年4月及び同年10月に締結しており、共同で当社連結子会社である株式会社UNIGENを運営しております。同契約が解除その他の理由で終了した場合や、同契約で予定されている共同事業の全部または一部が何らかの理由で停止した場合には、当社グループの原薬製造に支障が生じる可能性があり、事業戦略及び経営成績に重大な影響を及ぼす可能性があります。
④ アピ株式会社との提携契約への依存について
Section titled “④ アピ株式会社との提携契約への依存について”当社は、アピ株式会社と組換えインフルエンザHAワクチン製剤工程業務に関する包括提携に関し「基本協定書」を平成22年4月に締結、また、製造委託業務について具体的に定めた「製造委託基本契約書」を平成23年3月に締結しております。
「製造委託基本契約書」は、有効期間が同契約の締結日より10年間となっており、その1年前に双方のいずれかが解除を申し出ない限り、2年間の自動延長が付されております。同契約が期間満了、もしくは解除その他の理由で終了した場合や、同契約で予定されている委託業務の全部または一部が何らかの理由で停止した場合には、当社の組換えインフルエンザHAワクチン製造に支障が生ずる可能性があり、事業戦略及び経営成績に重大な影響を及ぼす可能性があります。
また、上述のとおり、当社は、アピ株式会社と独占的な製剤工程業務の委託契約を締結しております。アピ株式会社は、医薬品の製造及び製剤工程の受託実績が多数あり、優れた品質管理ノウハウの下、受託事業を行っております。しかしながら、当社が委託する製剤工程において、当社及びアステラス製薬株式会社が要求する品質が維持できない場合、アステラス製薬株式会社に対する供給量が減少するため、当社の売上が減少する可能性があります。また、アステラス製薬株式会社に対する供給責任が果たせない結果、当社との販売提携契約が解消される可能性があります。
⑤ 販売の季節変動性について
Section titled “⑤ 販売の季節変動性について”当社のUMN-0502は、販売期間が年後半の約3ヵ月間と非常に限られているため、UMN-0502販売以降は第2四半期までは売上はほとんど計上されず、営業損失が継続し、第3四半期及び第4四半期で営業利益が計上されることになります。また、キャッシュ・フローについても、製造活動時期が第2四半期及び第3四半期に集中することから、当該時期はマイナスが継続し、第4四半期及び翌連結会計年度の第1四半期に売掛金を回収することになります。
⑥ 競合他社について
Section titled “⑥ 競合他社について”細胞培養系インフルエンザワクチンは、当社の他に、一般財団法人阪大微生物病研究会、一般財団法人化学及血清療法研究所、武田薬品工業株式会社、北里第一三共ワクチン株式会社及びデンカ生研株式会社等が日本国内において開発を行っております。海外においては、当社の技術導入元であるPSCが、平成25年1月に季節性組換えインフルエンザHAワクチン「Flublok®」についてFDAより承認を取得しておりますが、Novartis International AG、Baxter International Inc.が細胞培養系インフルエンザワクチンの販売を行っており、また、GlaxoSmithKline plc、Sanofi Pasteur SA、Novavax,Inc.等が開発を行っております。今後、これら競合ワクチンが、当社が開発、製造及び販売の権利を保有する地域にて製造販売承認を得る結果、既存の鶏卵インフルエンザワクチンとともに、多数の競合製品が市場に存在することになる可能性があります。有効性、安全性において競合ワクチンとの差別化が図れず、他社製品に比較して劣る場合、当社が想定する獲得シェアを下回り、当社の売上及び利益に大きな影響を与える可能性があります。
⑦ 製造に関する不確実性について
Section titled “⑦ 製造に関する不確実性について”当社は、UMN-0502及びUMN-0501について、米国にてFDAの査察を受け承認された工場で生産された製品を治験用サンプルとして輸入し、臨床試験に供しております。また、今後将来において日本国内で製造した製品を供給することを目的として、秋田県秋田市に組換えインフルエンザHAワクチン原薬製造施設である秋田工場(以下、「秋田工場」といいます。)を保有し、加えて、当社連結子会社である株式会社UNIGENが岐阜県揖斐郡池田町に実生産施設である岐阜工場を保有しております。現在、秋田工場においては、株式会社UNIGENにより治験薬GMPに適合するための運転時適格性評価(Operation Qualification:OQ)を実施し、治験薬GMP体制下での運営体制を確立しております。また、岐阜工場においては、UMN-0502の承認申請に必要な各種品質データを取得することを目的とした性能適格性評価(Performance Qualification:PQ)を実施、品質及び製造コストの検証を行っております。将来においては、岐阜工場にて製造された製品を基にアステラス製薬株式会社、韓国の日東製薬株式会社がそれぞれ日本、韓国において個別に承認申請を行います。承認後は、アステラス製薬株式会社に対して最終製品を、日東製薬株式会社に対しては原薬を供給する予定であります。アステラス製薬株式会社の承認申請前に、岐阜工場にて製造業許可を当局に申請する予定でありますが、当局の判断によっては、施設の仕様変更または製造手順の変更を求められることにより、製造業許可が予定どおり得られない可能性があります。
また、販売開始後において、製造量・生産効率・原材料・資材価格動向によって製造原価が想定以上に上昇する可能性があります。なお、医薬品を販売するにあたっては、安定供給の責任があることから、一定規模以上の製造能力を保有し、また、製造委託を行うことが求められております。一方、需要量予測に基づく生産計画もしくは製造委託量を決定する必要があり、需要予測と実際の販売量に大幅な乖離が生じた場合、当社の収益に大きな影響を及ぼす可能性があります。
⑧ 原材料調達に関するリスクについて
Section titled “⑧ 原材料調達に関するリスクについて”組換えインフルエンザHAワクチンの原薬製造にあたっては、培養に必要な培地・精製カラム樹脂・精製バッファーなどの多数の原材料・資材を必要とします。また、製剤工程にあっては、バイアル・ゴム栓・包装資材等を必要とします。これらの原材料・資材の調達は、複数業者からの購買を基本とし、一定水準の原材料・資材在庫を確保する方針でありますが、当社が要求する量が供給されない場合、製品を安定的に供給できない可能性があります。また、一部の原材料・資材には有効期限が設定されていることから、大規模な原材料・資材の廃棄ロスが発生した場合、当社の収益に影響を及ぼす可能性があります。
⑨ 賠償問題発生リスクについて
Section titled “⑨ 賠償問題発生リスクについて”医薬品の臨床開発を実施する際には、薬剤による副作用などに伴う賠償問題が発生するリスクがあります。これに関し当社は、必要と認める損害保険への加入などによって、このような事態が発生した場合の財政的負担を最小限にすべく対応しております。しかしながら、賠償額が当該保険により保障される範囲を超える可能性は否定できず、その場合には財政状態及び経営成績に影響が及ぶ可能性があります。
また、医薬品の開発及び製造には、製造物責任賠償のリスクが内在します。当社グループは将来、開発または製造したいずれかの医薬品が健康被害を引き起こし、または臨床試験、製造及び販売において不適当な点が発見された場合には、製造物責任を負い、当社グループの業務及び経営成績、財務状況に影響を及ぼす可能性があります。また、製造物責任賠償請求がなされることによるイメージ低下により、当社グループ及び当社グループの医薬品に対する信頼が損なわれ、当社グループの事業に影響を与える可能性があります。
⑩ 新規開発パイプラインについて
Section titled “⑩ 新規開発パイプラインについて”当社グループは、今後さらに新規開発パイプラインを拡充する計画であり、研究開発費は今後も増加することが想定されます。現在の開発品の上市等による収益確保に至るまでには、一定の期間が必要であり、当面の間、累積損失は増大するものと想定されます。
⑪ 特許に関する訴訟及びクレームのリスクについて
Section titled “⑪ 特許に関する訴訟及びクレームのリスクについて”当社グループのパイプラインに関連する主な特許の状況は以下の表のとおりであります。
| パイプライン | 発明の名称 | 所有者 | 出願番号/登録番号 |
|---|---|---|---|
| UMN-0502/0501/0901 | インフルエンザ血球凝集素多価ワクチンの製造方法 | プロテインサイエンシーズ | 特許3757318号 |
| UMN-0502/0501/0901 | インフルエンザ血球凝集素多価ワクチンの製造方法 | プロテインサイエンシーズ | 特許4031478号 |
| UMN-0502/0501/0901 | インフルエンザ血球凝集素多価ワクチンの製造方法 | プロテインサイエンシーズ | 特許3918949号 |
| UMN-0502/0501/0901 | インフルエンザ血球凝集素多価ワクチンの製造方法 | プロテインサイエンシーズ | 特願2009-023520 |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | PCT/FI/2001/050880 |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | W02012049366 |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | EP2011832191A |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | FI20106067A |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | TW201137092A |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | SG20132797A |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | CN201180049612A |
| UMN-2003 | 混合ワクチンとして使用するためのノロウイルスカプシド及びロタウイルスVP6タンパク質 | ヴェシカリ ティモ、ブラジェヴィッチ ヴェスナ | 特願2013-533249A |
| パイプライン | 発明の名称 | 所有者 | 出願番号/登録番号 |
|---|---|---|---|
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | AU2011315405A |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | CA2814175A |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | US13269326A |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | 723/MUMNP/2013 |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | MX2013004159 |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | BR1120130091643 |
| UMN-2003 | NOROVIRUS CAPSID AND ROTAVIRUS VP6 PROTEIN FOR USE AS COMBINED VACCINE | VESIKARI, TIMO et al. | BU2013121815 |
本有価証券報告書提出日現在において、当社グループの開発及び製造に関連した特許権等の知的財産権について、第三者との間で訴訟及びクレームが発生した事実はありません。
また、当社グループは今後発生し得るこのような問題を未然に防止するため、事業展開にあたっては弁護士との相談や特許事務所を通じた特許調査を適宜実施しており、現時点において、当社グループの事業が第三者の特許権等に抵触する可能性は低いものと認識しております。
しかしながら、当社グループのような研究開発型の企業にとって、差止請求、損害賠償請求、実施料請求等の知的財産権侵害問題の可能性を完全に排除することは困難であります。また、当社グループが第三者との法的紛争に巻き込まれた場合、解決に時間及び多大な費用を要する可能性があり、さらに、当社グループが第三者から差止請求権や損害賠償請求権を行使されたり、高額な実施料を請求されたりすることにより、当社グループの事業戦略や経営成績、財政状態に重大な影響を及ぼす可能性があります。
⑫ 特許の確保に関するリスクについて
Section titled “⑫ 特許の確保に関するリスクについて”当社グループが職務発明の発明者である役職員等から特許を受ける権利を譲り受けた場合、当社グループは発明者に対して特許法第35条第3項に定める「相当の対価」を支払わなければなりません。これまでに対価の支払いについて発明者との間で問題が生じたことはありませんが、対価の相当性につき紛争が発生する可能性を将来にわたり完全に排除することはできません。紛争が生じた場合や発明者に追加の対価を支払わなければならない場合には、当社グループの財政状態や経営成績に影響を及ぼす恐れがあります。
また、当社グループが過去に譲り受けた特許及び出願特許について、当社グループまたは前保有者が第三者により使用権や担保権の主張を受ける可能性を完全に排除することはできず、かかる主張を受けた場合には、当社グループの事業戦略、財政状態や経営成績に影響を及ぼす可能性があります。
⑬ 法規制の改正に関するリスクについて
Section titled “⑬ 法規制の改正に関するリスクについて”今後、当社グループが開発する組換えタンパク医薬品の製造販売承認、医薬品製造に関連する許認可並びに関連する法令の大幅な改正、または新たな法律が制定される可能性があります。これらの改正、制定により、新たな臨床試験や設備投資が発生する可能性があり、これまで投資した既存固定資産の除却等が発生する可能性があります。
⑭ 海外展開に関するリスクについて
Section titled “⑭ 海外展開に関するリスクについて”当社が権利を取得している中国・韓国・台湾・香港・シンガポールにおいて、規制当局における医薬品の製造販売許可要件が大きく変更となる可能性があります。特にインフルエンザワクチンに関する許認可の運用については、各国ともに流動的であることから、当社が現在想定する事業展開計画に大きな影響を及ぼす可能性があります。また、開発・製造・販売に係る提携形態によって、海外展開のための投資額が想定よりも多大となる可能性があります。さらに、合意した経済条件によっては、想定する売上及び利益計画を大幅に下回る可能性があります。
⑮ ヴェシカリ教授・ブラゼヴィッチ博士とのライセンス契約における契約解除の可能性について
Section titled “⑮ ヴェシカリ教授・ブラゼヴィッチ博士とのライセンス契約における契約解除の可能性について”平成24年1月に締結したヴェシカリ教授・ブラゼヴィッチ博士との組換えノロウイルスVLP+組換えロタウイルスVP6混合ワクチンの全世界における独占的事業化権に係る契約において、契約解除条項は、以下のとおりとなっております。
「一方に回復出来ない義務違反があった場合、60日前までの通知で他方が解約できる。」
この他に契約解除条項は付されておりませんので、当該条項に該当する事案が発生する可能性は極めて低いと考えておりますが、何らかの理由により当該条項に抵触した結果、契約が解除された場合、当社グループの新たなパイプラインであるUMN-2003に関する事業を中止せざるを得なくなる結果、当社グループの事業戦略に影響を及ぼす可能性があります。
(3)会社組織に関するリスク
Section titled “(3)会社組織に関するリスク”① 業歴が浅いことについて
Section titled “① 業歴が浅いことについて”当社は、医療用医薬品の研究開発・製造・販売を主な事業目的として、平成16年に設立された業歴の浅い会社であり、現時点まで、提携によるマイルストーンペイメント収入は計上されたものの、製品売上による事業収益はまだ計上しておりません。
今後、生産施設での製造許可の取得及び提携先による承認取得後の製品出荷に至るまでの間に未だ経験していない事業上のトラブルが発生する可能性は否定できず、当社グループの業績に影響を及ぼすと考えられる外部環境の変化についても予想することは現状では困難であると思われます。
② 小規模組織であることについて
Section titled “② 小規模組織であることについて”当社グループの人員は、平成25年12月31日現在、常勤取締役3名、子会社常勤取締役2名、従業員91名であります。また、このうち製造部門及び研究開発部門は74名であります。当社グループの研究開発活動は、基礎研究から臨床開発まで様々な研究開発段階において提携企業との共同研究、業務委託企業の積極活用により、目的を達成できる体制を構築しておりますが、今後の製造体制の確立、パイプラインの充実に対応するため、製造部門及び研究開発部門の人員増強を計画しております。
しかしながら、何らかの理由で、提携関係または業務受託企業との関係が解消された場合や、計画どおり人員が確保できなかった場合、あるいは既存人員の流出が生じた場合には、当社グループの活動に支障が生じ、当社グループの財政状態及び経営成績に影響が及ぶ可能性があります。
③ 少数の事業推進者への依存について
Section titled “③ 少数の事業推進者への依存について”当社グループの事業戦略を達成するためには、取締役をはじめとする、当社グループの事業戦略を推進する各部門の責任者に大きく依存するところがあります。今後も当社グループは優秀な人材の確保及び社内教育に努めてまいりますが、人材の確保及び社内人材の教育が計画どおりに進まない場合、または人材の流出が生じた場合には、当社グループの事業戦略及び経営成績に支障をきたす可能性があります。当社グループは、少数の事業推進者に過度に依存しない体制を構築すべく経営組織の強化を図っておりますが、当面は依存度の高い状態で推移するため、何らかの理由で、当社グループにおける業務遂行に支障をきたした場合、当社グループの事業戦略や経営成績に影響を及ぼす可能性があります。
④ 研究開発における外部への委託について
Section titled “④ 研究開発における外部への委託について”当社グループは、自社資源の有効活用及び機動的な事業運営を図るため、研究開発における定型業務の一部について外部に委託しております。
業務委託先において、担当者の異動、事業規模の縮小による人員減、経営状況の悪化による事業停止等が生じた場合、委託業務の進捗が大幅に遅れることにより、当社の研究開発業務の進捗に大きな影響を及ぼす可能性があります。また、上記の委託業務を他の委託先に切り替える場合、切り替えに一定の期間を要することから、同様に研究開発業務の進捗に大きな影響を及ぼす可能性があります。
⑤ 天変地異について
Section titled “⑤ 天変地異について”当社グループは、研究開発施設は神奈川県横浜市港北区及び秋田県秋田市に、生産施設は秋田県秋田市及び岐阜県揖斐郡池田町にあります。これらの地域において、大規模災害等があった場合、当社グループが保有する設備の破損等により製品供給に支障をきたし、当社グループの業績及び財務状態に影響を受ける可能性があります。
⑥ 情報管理に関するリスクについて
Section titled “⑥ 情報管理に関するリスクについて”当社グループの研究または開発途上の知見・技術・ノウハウ等重要な機密情報が流出した場合には、当社グループの事業戦略及び経営成績に影響を及ぼす可能性があります。このリスクを低減するため、当社グループは役職員、取引先との間で、守秘義務等を定めた契約を締結するなど、厳重な情報管理に努めております。しかしながら、役職員、取引先等により、これらが順守されなかった場合には、重要な機密情報が漏えいする可能性があり、かかる場合には当社グループの事業に影響を与える可能性があります。
(4)業績等に関する事項
Section titled “(4)業績等に関する事項”① 経営成績の推移(過年度における業績推移)について
Section titled “① 経営成績の推移(過年度における業績推移)について”当社グループの主な売上高は、提携時に受領する契約一時金収入、提携済みパイプラインの開発進捗に応じたマイルストーンペイメント収入、上市後に当社が提携先に正味販売価格の一定率にて製品を供給することにより得られる製品売上、及びバイオ医薬品の受託製造売上による収入であります。しかしながら、これらの売上高は、提携済みパイプラインの開発進捗、UMN-0502、UMN-0501及びUMN-0901の東アジア展開、UMN-2003、UMN-2002及び新規開発パイプラインの提携の有無、さらに提携済みパイプラインの上市後の販売量に大きく依存しており、過年度において毎年経常的に収益を計上しているものではないため、上記のように売上、経常利益または経常損失、当期純利益または当期純損失の推移は安定しておりません。また、平成25年5月より、当社連結子会社である株式会社UNIGENにて岐阜工場が稼働した結果、連結業績において不安定さが増しております。さらに当社は、平成16年4月に設立したばかりの会社であり、上市された製品がなく、全て承認申請準備段階または研究開発段階にあることから、過年度の財務状況、経営指標及び今後開示する四半期毎の業績は、業績比較並びに今後の業績予想を判断する材料としては不十分であります。
当社グループは、これまで開発パイプラインの承認を目指して研究開発活動に重点的に取り組んでまいりました。第7期において連結ベースにて当期純利益を計上しておりますが、単体の当期純利益を下回っており、第7期以外は、当期純損失を計上しております。今後も引き続き研究開発投資を行う計画であり、研究開発の進捗等によって業績に大きな影響を与える可能性があります。
② マイナスの繰越利益剰余金を計上していることについて
Section titled “② マイナスの繰越利益剰余金を計上していることについて”当社グループは、研究開発及び製造を主な事業領域とするバイオベンチャー企業であり、製品の販売が開始され、一定の製品供給量に達し、安定的な収益を計上できる体制に至るまでは、開発進捗に応じたマイルストーンペイメント収入が見込まれるものの、当社グループが保有する生産施設立上げのためのバリデーション、製造能力向上のための設備増強、新規開発パイプラインの導入並びに研究開発に係る投資が先行することになります。当社グループは、連結初年度である第7期は当期純利益を計上したものの、第8期、第9期及び第10期は当期純損失を計上し、単体においても、同様の期に当期純損失を計上しており、マイナスの繰越利益剰余金を計上しております。
当社グループは、UMN-0502、UMN-0501及びUMN-0901の東アジア展開、UMN-2003、UMN-2002及び新規開発パイプラインの提携に伴う一時金並びに開発の進捗に伴うマイルストーンペイメントの収受、及びバイオ医薬品受託製造の収益により利益の確保を目指してまいりますが、将来において計画どおりに提携等が実現できなかった場合、当期純利益を計上できない可能性があります。また、提携済みパイプラインの臨床開発または製造工場のバリデーションが計画どおりに進展しない結果、利益計上時期が遅れることにより、マイナスの繰越利益剰余金がプラスに転じる時期が遅れる可能性があります。
③ 資金繰りについて
Section titled “③ 資金繰りについて”当社グループは、研究開発のみならず組換えインフルエンザHAワクチンをはじめとするバイオ医薬品の原薬生産施設を有するため、研究開発に加えて生産施設のバリデーション及び継続的な設備投資のための資金を必要としております。計画どおりに事業が進展しない結果、想定した時期に資金を確保できなかった場合には資金が不足し、その資金繰りの状況によっては、当社グループの事業存続に影響を及ぼす可能性があります。
④ 税務上の繰越欠損金について
Section titled “④ 税務上の繰越欠損金について”本有価証券報告書提出日現在において、当社は税務上の繰越欠損金を有しております。当社グループの業績が順調に推移する結果、繰越欠損金が解消され課税所得控除が受けられなくなった場合、通常の税率に基づく法人税、住民税及び事業税が課せられることとなり、現在想定している当期純利益もしくは当期純損失及びキャッシュ・フローの計画に影響を与える可能性があります。
(5)シンジケートローンにおける財務制限条項及びUMN-0502開発スケジュール遵守条項について
Section titled “(5)シンジケートローンにおける財務制限条項及びUMN-0502開発スケジュール遵守条項について”当社連結子会社である株式会社UNIGENは、岐阜工場建設資金の安定的な資金調達を目的として、株式会社三井住友銀行をアレンジャーとして平成24年2月に金融機関等10社と総額10,500,000千円のシンジケートローン契約を、同年9月に金融機関等4社と総額2,500,000千円のシンジケートローン契約をそれぞれ締結しております。シンジケートローン契約において、財務制限条項が付されております。また、当社が計画するUMN-0502の開発スケジュール遵守条項が付されております。これらの条項に抵触した場合、3分の2超の貸付人の請求により、債務の返済を求められることになります。この場合、当社グループの財政状況及び経営成績に大きな影響を及ぼす可能性があります。
(6)助成金の返還リスクについて
Section titled “(6)助成金の返還リスクについて”当社の秋田工場及び横浜研究所における主要設備は、平成22年7月に採択された厚生労働省「新型インフルエンザワクチン開発・生産体制整備臨時特例交付金」交付事業(第一次分)にて交付を受けた助成金にて整備しております。本助成金交付要綱において、本助成事業にて購入した設備については、当社が責任をもって適切に管理監督を行い、効率的な運用に努める必要があります。また、本助成金交付要綱には、交付の目的として「事業実施団体が、新型インフルエンザワクチンの開発・生産体制を整備し、新型インフルエンザの発生・流行時に必要なワクチンをより迅速に製造できる体制を確保するとともに、有効性や安全性の高い新型インフルエンザワクチンの開発・生産を推進するために必要な経費に対して、新型インフルエンザ基金から助成を行うことにより、国民の保健衛生の向上に寄与すること」が明記されており、当該目的外に使用しないことが規定されております。
当社は、当局の了承を得て、当社連結子会社である株式会社UNIGENに秋田工場を貸与し、当社とともに秋田工場の管理監督を実施しております。今後も交付目的に合致した運用をしてまいりますが、当局の監査の結果、管理監督に不備が見つかった場合や、目的外使用と認定される等により助成金の全部または一部の返還命令を受けた場合には、当社の資金計画及び経営成績に大きな影響を及ぼす可能性があります。
また、上記助成金以外にも、当社グループがこれまでに収受した助成金等について、各助成金の交付要綱に抵触した結果、交付指定の取消等により、助成金の全額または一部について返還命令を受けた場合には、当社グループの資金計画及び経営成績に大きな影響を及ぼす可能性があります
(7)為替変動リスクについて
Section titled “(7)為替変動リスクについて”当社の売上原価の一部及び研究開発費の一部について外貨建取引が含まれておりますが、為替予約等による為替リスクヘッジは行っておりません。短期間に為替相場が大幅に変動した場合、当社グループの経営成績に悪影響を及ぼす可能性があります。
(8)配当政策について
Section titled “(8)配当政策について”当社は、研究開発における先行投資を継続して行っているため、創業以来、株主に対する利益配当及び剰余金配当による利益還元を実施しておりません。今後については、企業価値を確固たるものにするために、既存開発パイプラインの進展及び新規開発パイプラインの充実を図ることが重要なことから、積極的に研究開発資金を投入してまいります。したがって、当面は利益配当を実施せず、内部留保を行い、研究開発活動の強化に備えた資金確保を優先いたします。しかしながら、株主への利益還元についても重要な経営課題と認識しており、当社グループの経営成績及び財政状態、事業計画等を総合的に勘案した上で、利益配当を検討していくことになります。一方、当社グループの業績が計画どおりとならない結果、利益配当原資を確保できず、利益配当時期が遅延するなどの可能性があります。
(9)調達資金の使途について
Section titled “(9)調達資金の使途について”当社グループは、今後、提携済みパイプラインの臨床試験に係る一部の費用、UMN-0502、UMN-0501及びUMN-0901の東アジア展開、UMN-2003、UMN-2002及び新規開発パイプラインの研究開発に加えて、組換えインフルエンザHAワクチンを安定的に供給するため継続的に原薬製造施設の整備及び増強を行う必要があり、多額の資金を必要としております。
当社が、平成24年12月に実施した公募増資資金の使途については、主に組換えインフルエンザHAワクチンをはじめとするバイオ医薬品原薬生産施設の建設費用に充当しております。また、平成25年10月に実施したアステラス製薬株式会社を割当先とする第三者割当増資及び野村證券株式会社を割当先とする行使価額修正条項付新株予約権付社債券等の行使により調達した資金の使途については、研究開発投資に加えて、原薬生産施設への設備投資並びに借入金返済に充当することを計画しております。しかしながら、資金需要の発生時期及びその規模について大幅に変更される可能性があり、また原薬生産施設への投資資金が計画どおり回収できない場合、当社グループの事業展開、財政状態及び経営成績に影響を及ぼす可能性があります。
(10)VC等の当社株式保有比率について
Section titled “(10)VC等の当社株式保有比率について”一般的に、VC等が未公開株式に投資を行う目的は、公開後に当該株式を市場にて売却しキャピタルゲインを得ることであることから、VC等は当社の株式公開後において所有する株式の一部または全部を売却することが想定されます。当該株式売却により、短期的に需給バランスの悪化が生じる可能性があり、当社株式の市場価格が低下する可能性があります。
(11)ストック・オプション及び第三者割当新株予約権の行使による株式価値の希薄化について
Section titled “(11)ストック・オプション及び第三者割当新株予約権の行使による株式価値の希薄化について”当社は、当社及び当社グループの役員、従業員及び社外協力者に対して、当社の業績向上に対する意欲や士気を高めることを目的として、ストック・オプションによる新株予約権の発行を行っております。また、平成25年10月17日付で野村證券株式会社を割当先とした新株予約権を発行しております。これらが行使された場合には、当社の1株当たりの株式価値を希薄化することになる可能性があります。
また今後も、優秀な人材確保のためのインセンティブプランとしてストック・オプションや資金調達のための新株予約権、新株予約権付社債等を発行する可能性がありますので、これらの場合にはさらに1株当たりの株式価値が希薄化する可能性があります。なお、平成25年12月31日現在、ストック・オプション及び第三者割当新株予約権による潜在株式数はそれぞれ118,000株及び488,400株であり、合計606,400株となっております。これは、当社の発行済株式総数8,425,900株に対し、7.20%に相当いたします。
5 【経営上の重要な契約等】
Section titled “5 【経営上の重要な契約等】”(1)技術導入契約
Section titled “(1)技術導入契約”| 会社名 | 相手方の名称 | 国名 | 契約品目 | 契約締結日 | 契約内容 | 契約期間 |
| 当社 | Protein Sciences Corporation (PSC) | 米国 | UMN-0502UMN-0501UMN-0901 | 平成18年8月22日 | ・BEVSによる組換えタンパク製造技術を用いた遺伝子組換え型インフルエンザHAワクチンの、日本における独占的な開発・製造ならびに販売権をPSCが許諾・一時金、マイルストーンペイメント・一定料率のロイヤリティを株式会社UMNファーマが支払 | 期間の定めなし |
| 平成22年10月22日 | ・BEVSによる組換えタンパク製造技術を用いた遺伝子組換え型インフルエンザHAワクチンの、中国・韓国・台湾・香港・シンガポールにおける独占的な開発・製造ならびに販売権をPSCが許諾・一時金、マイルストーンペイメント・一定料率のロイヤリティを株式会社UMNファーマが支払 | 期間の定めなし | ||||
| 当社 | Timo Vesikari, Vesna Blazevic | フィンランド | UMN-2003 | 平成24年1月23日 | ・ノロウイルスとロタウイルスの抗原を含むワクチンの全世界での独占的事業化権を特許所有者が許諾・一時金、マイルストーンペイメント・一定料率のロイヤリティを株式会社UMNファーマが支払 | 特許期間満了まで |
(2)UMN-0502及びUMN-0501の日本国内での共同開発及び販売に関する契約
Section titled “(2)UMN-0502及びUMN-0501の日本国内での共同開発及び販売に関する契約”| 会社名 | 相手方の名称 | 国名 | 契約品目 | 契約締結日 | 契約内容 | 契約期間 |
|---|---|---|---|---|---|---|
| 当社 | アステラス製薬株式会社 | 日本 | UMN-0502UMN-0501 | 平成22年9月21日 | ・UMN-0502及びUMN-0501の日本での共同開発、独占的販売権のアステラス製薬株式会社への許諾・今後の開発は主としてアステラス製薬株式会社が進めるとともに、当該開発費用を全て負担・開発期間中の治験薬等は株式会社UMNファーマが無償提供・株式会社UMNファーマは最終製品まで生産を手掛け、アステラス製薬株式会社に供給し、アステラス製薬株式会社が販売・契約締結一時金・マイルストーンペイメント・販売高に応じた一定料率のロイヤリティをアステラス製薬株式会社が支払 | 期間の定めなし |
(3)UMN-0502、UMN-0501及びUMN-0901の韓国国内での製剤製造、輸入、共同開発及び販売に関する
Section titled “(3)UMN-0502、UMN-0501及びUMN-0901の韓国国内での製剤製造、輸入、共同開発及び販売に関する”契約
| 会社名 | 相手方の名称 | 国名 | 契約品目 | 契約締結日 | 契約内容 | 契約期間 |
|---|---|---|---|---|---|---|
| 当社 | 日東製薬株式会社 | 韓国 | UMN-0502UMN-0501 UMN-0901 | 平成24年12月28日 | ・UMN-0502、UMN-0501及びUMN-0901の韓国での製剤製造、輸入、共同開発、独占的販売権の日東製薬株式会社への許諾・開発は主として日東製薬株式会社が進めるとともに、当該開発費用を全て負担・開発期間中の治験薬等は株式会社UMNファーマが有償提供・株式会社UMNファーマは、原薬の生産を手掛け、日東製薬株式会社に供給し、日東製薬株式会社が製剤製造及び販売、あるいは、株式会社UMNファーマは、最終製品までを手掛け、日東製薬株式会社に供給し、日東製薬株式会社が販売・契約締結一時金・マイルストーンペイメント・販売高に応じた一定料率のロイヤリティを日東製薬株式会社が支払 | 期間の定めなし |
(4)組換えインフルエンザHAワクチン原薬製造及び製剤化委託に関する契約
Section titled “(4)組換えインフルエンザHAワクチン原薬製造及び製剤化委託に関する契約”| 会社名 | 相手方の名称 | 国名 | 契約品目 | 契約締結日 | 契約内容 | 契約期間 |
|---|---|---|---|---|---|---|
| 当社 | 株式会社IHI | 日本 | UMN-0502UMN-0501 | 平成22年1月25日 | ・組換えインフルエンザHAワクチン原薬の製造子会社を共同で設立・両社の関係強化と本事業の着実な推進のため、株式会社IHIは、株式会社UMNファーマと資本関係を構築・組換えインフルエンザHAワクチン原薬製造設備を秋田県秋田市に建設し、平成24年の生産開始を予定 | 期間の定めなし |
| 当社 | アピ株式会社 | 日本 | UMN-0502UMN-0501その他組換えインフルエンザHAワクチン | 平成23年3月25日 | ・組換えインフルエンザHAワクチンの製剤工程を独占的にアピ株式会社に対して委託・製剤工程業務、最終製品及び中間製品の製造管理及び品質管理業務をアピが受託・株式会社UMNファーマは、上記委託を実施するために、製剤工程以下の本製造における独占的製剤製造実施権をアピ株式会社に対して無償で許諾。ただし、アピ株式会社が安定的及び継続的に供給ができない事実が発生し、又はその虞があるとどちらか一方が判断した場合は、非継続的かつ限定的に他の第三者に製剤工程業務を委託することができる・パンデミックの際に国よりパンデミックインフルエンザワクチンの製造指示があった場合、有事が収束するまでの間、対象となる品目の製造及び関連業務を優先して取り組む | 平成23年3月25日より10年間、但し、期間満了の1年前までに双方のいずれからも終了の意思表示がない限り、本契約は2年間延長されるものとし、以後も同様とする。 |
(5)組換えインフルエンザHAワクチン原薬製造に関する変更契約
Section titled “(5)組換えインフルエンザHAワクチン原薬製造に関する変更契約”| 会社名 | 相手方の名称 | 国名 | 契約品目 | 契約締結日 | 契約内容 | 契約期間 |
|---|---|---|---|---|---|---|
| 当社 | 株式会社IHI | 日本 | バイオ医薬品 | 平成24年4月16日 | ・協業範囲をBEVSを用いたインフルエンザワクチン原薬製造事業に留まらず、BEVSを用いたバイオ医薬品原薬製造事業とする・株式会社UNIGENに対し、株式会社UMNファーマが自社で開発するBEVSを用いたバイオ医薬品原薬の製造を委託する・株式会社IHIが要請した場合、株式会社UNIGENの出資比率を株式会社IHI50%、株式会社UMNファーマ50%に変更することに合意する | 期間の定めなし |
(6)組換えインフルエンザHAワクチン原薬製造に関する変更契約の修正契約
Section titled “(6)組換えインフルエンザHAワクチン原薬製造に関する変更契約の修正契約”| 会社名 | 相手方の名称 | 国名 | 契約品目 | 契約締結日 | 契約内容 | 契約期間 |
|---|---|---|---|---|---|---|
| 当社 | 株式会社IHI | 日本 | バイオ医薬品 | 平成24年10月15日 | ・株式会社IHIは、株式会社UMNファーマに対して非常勤取締役候補者1名を推薦することができる・株式会社IHIが取締役候補者を推薦することができる期間は、平成24年2月29日付締結「保証委託契約書」に基づく債務保証委託期間とする | 債務保証残高がゼロになる時まで |
(7)保証委託契約
Section titled “(7)保証委託契約”| 会社名 | 相手方の名称 | 国名 | 契約品目 | 契約締結日 | 契約内容 | 契約期間 |
|---|---|---|---|---|---|---|
| 当社及び子会社 | 株式会社IHI | 日本 | - | 平成26年3月31日 | ・株式会社UNIGENを借入人とし、株式会社UMNファーマを連帯保証人とし、株式会社三井住友銀行をエージェントとして構成される全貸付人との間で締結された平成26年3月31日付「シンジケートローン契約」に基づき、株式会社UNIGEN及び株式会社UMNファーマは、株式会社UNIGENが各貸付人に対して負担するシンジケートローン契約に限定した特定債務について、金5,000,000千円を保証上限額として株式会社IHIに債務保証を委託する | 債務保証残高がゼロになる時まで |
| 当社及び子会社 | 株式会社IHI | 日本 | - | 平成26年3月31日 | ・株式会社UNIGENを借入人とし、株式会社UMNファーマを連帯保証人とし、株式会社三井住友銀行をエージェントとして構成される全貸付人との間で締結された平成26年3月31日付「シンジケートローン契約」に基づき、株式会社UNIGEN及び株式会社UMNファーマは、株式会社UNIGENが各貸付人に対して負担するシンジケートローン契約に限定した特定債務について、金1,500,000千円を保証上限額として株式会社IHIに債務保証を委託する | 債務保証残高がゼロになる時まで |
(8)BCMO事業提携契約
Section titled “(8)BCMO事業提携契約”| 会社名 | 相手方の名称 | 国名 | 契約品目 | 契約締結日 | 契約内容 | 契約期間 |
|---|---|---|---|---|---|---|
| 当社及び子会社 | アピ株式会社 | 日本 | - | 平成24年7月13日 | ・開発段階にある遺伝子組換え技術を用いたバイオ医薬品の原薬製造、製剤製造及びこれらに係る評価試験等の第三者からのバイオ医薬品受託製造事業(BCMO事業)及びBCMO事業に係る営業活動を共同で実施する | 期間の定めなし |
(9)共同事業契約
| 会社名 | 相手方の名称 | 国名 | 契約品目 | 契約締結日 | 契約内容 | 契約期間 |
|---|---|---|---|---|---|---|
| 当社 | アピ株式会社株式会社ヤクルト本社 | 日本 | 抗体バイオ後続品 | 平成25年6月20日及び平成25年 12月17日 | ・がん領域における抗体バイオ後続品の研究・開発・製造・販売を共同で実施する | 期間の定めなし |
6 【研究開発活動】
Section titled “6 【研究開発活動】”当社グループは、自社開発事業においては、主にバイオ医薬品の研究開発活動並びにBEVS技術を用いたUMN-0502、UMN-0501、UMN-0901及びUMN-2003の量産体制の構築を行っております。また、バイオ医薬品受託製造事業においては、Catalent Pharma Solutions,Inc.から供給を受けた抗体医薬品の産生細胞株を用いて、商用生産に向けた各種検討を行っております。
当連結会計年度の研究開発費は、3,925,197千円であります。
(1)研究開発体制
Section titled “(1)研究開発体制”各種動物実験等を行う基礎研究部門については、秋田大学医学部内にある秋田研究所を拠点としております。また、BEVS技術を用いた量産体制の構築を目的とした初期検討にあたっては、横浜研究所を拠点として当社研究部門が中心となり研究開発を行っております。また、秋田工場の治験薬GMP製造体制の整備に係る各種活動については、当社連結子会社である株式会社UNIGENが中心となって、医薬品製造の関連法令に則り進めております。非臨床開発及び臨床開発については、非臨床開発部門及び臨床開発部門が実施しております。非臨床開発に係る試験の一部については、経験豊かなアウトソーシング先に委託しており、また、臨床開発についても、経験豊かなCROに対して一部業務を委託しております。また、治験用サンプルについては、PSCより輸入し、臨床試験に供しております。これら一連の開発業務について品質を担保するため、信頼性保証部を独立部門として設置し、業務監査を行い、法令遵守に務めております。
平成25年12月31日現在、当社グループの研究開発人員は74名(従業員のみ)となっておりますが、経験豊富な取締役が各部門を適切にマネジメントするとともに、各部門間の連携を密接に行い、効率的かつ効果的な研究開発活動の推進を行っております。
また、東アジアへのUMN-0502、UMN-0501及びUMN-0901の事業展開活動、継続的な新規パイプラインの導入活動、及びバイオ医薬品受託製造事業に係る受注活動等事業開発部を中心として積極的に推進しております。
(2)組換えインフルエンザHAワクチンの研究開発活動
Section titled “(2)組換えインフルエンザHAワクチンの研究開発活動”UMN-0502については、アステラス製薬株式会社が国内において実施した65歳以上高齢被験者1,060例を対象とした皮下接種での第Ⅲ相臨床試験にて、国内既承認孵化鶏卵ワクチンに対し、主要評価項目である免疫原性における非劣性基準を満たすとともに、安全性に大きな問題がないことを確認いたしました。この結果を受けて、20歳から65歳未満の健康成人被験者900例を対象とした皮下接種でのUMN-0502と国内既承認孵化鶏卵ワクチンの免疫原性及び安全性を比較することを目的とする第Ⅲ相臨床試験及び61歳以上健康成人被験者55例を対象とした筋肉内接種での免疫原性及び安全性を確認することを目的とする第Ⅲ相臨床試験を開始、平成25年10月には全例への接種が完了いたしました。
UMN-0501については、平成22年7月に厚生労働省の「新型インフルエンザワクチン開発・生産体制整備臨時特例交付金」交付事業(第一次分)として採択され、本事業の一部として、より迅速かつ、より大量のワクチンを製造するための各種検討を行っております。臨床開発につきましては、平成21年に実施した第Ⅱ相臨床試験の被験者を対象として、第Ⅱ相臨床試験で用いたワクチンの製造時に使用したH5N1亜型インフルエンザウイルス株とは異なるクレード(分類群)に属するH5N1亜型ウイルス株を用いて製造したワクチンを追加接種することによる免疫の賦活化(ブースター効果)を確認するための臨床試験を実施し、現在、データを考察しているところであります。パンデミックの発生時、いち早く新しいワクチンを接種しても、十分な量の抗体を産生するためには相応の時間がかかるため、UMN-0501のブースター効果が認められれば、パンデミック発生前にあらかじめUMN-0501で免疫することで、追加のワクチン接種により短時間で高い免疫が得られ、感染しても重症化、死亡の回避が可能になることが期待されます。平成23年8月より、共同開発先であるアステラス製薬株式会社とともに、第Ⅱ相臨床試験(高用量)を実施し、良好な免疫原性と優れた忍容性を確認しております。
アステラス製薬株式会社との共同開発に関しては、研究開発遂行のための共同会議体を設置し、製造販売承認申請に向けた研究開発活動を共同で推進しております。
さらに、H5N1亜型以外のインフルエンザパンデミックに備え、H9N2亜型に対する予防ワクチンであるUMN-0901の開発にも着手しております。
(3)組換えノロウイルスVLP+組換えロタウイルスVP6混合ワクチンの研究開発活動
Section titled “(3)組換えノロウイルスVLP+組換えロタウイルスVP6混合ワクチンの研究開発活動”UMN-2003については、ワクチン接種量と免疫原性の関係を確認する非臨床試験をタンペレ大学ワクチン研究センターで実施しております。また、原薬製造工程及び規格試験方法の確立・製剤化の検討を当社横浜研究所にて実施し、原薬製造に必要な工程を確立いたしました。早期に臨床試験を開始すべく、当社にて確立した原薬製造工程を基に、非臨床試験及び臨床試験実施に必要な原薬製造を、PSCにて実施しております。
(4)BEVSを用いた原薬生産拠点の整備
Section titled “(4)BEVSを用いた原薬生産拠点の整備”当社グループにおける中長期事業基盤であるBEVS技術について、技術導入元からの技術移転を完了するとともに、日本国内における原薬生産拠点の整備に注力してまいりました。秋田工場は、原薬生産施設として、当社が開発する組換えインフルエンザHAワクチンの供給体制を整備するための基盤となります。なお、秋田工場の建設費用の大部分は、前述の厚生労働省「新型インフルエンザ開発・製造体制整備臨時特例交付金」交付事業(第一次分)助成金にて整備を行っております。
また、当社連結子会社の株式会社UNIGENが岐阜県揖斐郡池田町において、より大規模な実生産スケールの生産施設となる岐阜工場を建設いたしました。なお、岐阜工場は、経済産業省「平成23年度国内立地推進事業費補助金」一次公募対象企業に採択されており、建設資金の一部について補助を受ける見込みであります。
当社グループでは、当該設備の立上げを確実に行うべく、医薬品生産経験のある人材の重点的な配置、人材強化に努めるとともに、継続した人材確保を進め、GMP医薬品原薬工場としての体制整備を図っております。また、ワクチン上市後における安定供給を目的とした製造能力の強化にも積極的に取り組んでおります。
ワクチン上市後のアステラス製薬株式会社による販売に向け、当社グループで製造した組換えインフルエンザHAワクチン原薬の製剤工程について、アピ株式会社と包括的な業務提携を行っており、人材交流も含めた製剤工程検討活動を行っております。なお、韓国市場については、日東製薬株式会社に対して原薬を輸出、日東製薬株式会社が製剤化を行い販売する計画であります。
(5)バイオ医薬品受託製造の研究開発活動
Catalent Pharma Solutions,Inc.より、抗体医薬品の生産細胞株を入手し、培養及び精製条件の最適化及び先発品との同等性評価を当社横浜研究所にて実施しております。
7 【財政状態、経営成績及びキャッシュ・フローの状況の分析】
Section titled “7 【財政状態、経営成績及びキャッシュ・フローの状況の分析】”(1)重要な会計方針及び見積り
Section titled “(1)重要な会計方針及び見積り”当社グループの連結財務諸表は、わが国において一般に公正妥当と認められる企業会計の基準に基づき作成されております。その作成には、経営者による会計方針の選択・適用、資産・負債及び収益・費用の報告金額及び開示に影響を与える見積りを必要とします。経営者は、これらの見積りについて過去の実績、適切な仮定に基づいて合理的に判断しておりますが、実際の結果と相違する場合があります。
なお、文中における将来に関する事項は、本有価証券報告書提出日現在において判断したものであります。
(2)経営成績の分析
Section titled “(2)経営成績の分析”第10期連結会計年度において、台湾の國光生物科技股份有限公司とUMN-0502、UMN-0501及びUMN-0901の台湾及び中国における商業化に関する優先交渉権を供与する契約締結一時金等の収受などにより、売上高は93,379千円(前年同期比13.7%減)となり、売上総利益は66,146千円となりました。
販売費及び一般管理費は4,488,124千円となりました。このうち研究開発費は3,925,197千円、その他の販売費及び一般管理費は562,926千円であります。
この結果、営業損失は4,421,977千円(前連結会計年度の営業損失2,072,550千円)、経常損失は4,147,960千円(前連結会計年度の経常損失2,652,395千円)、当期純損失は3,717,117千円(前連結会計年度の当期純損失1,996,917千円)となりました。
(3)財政状態に関する分析
Section titled “(3)財政状態に関する分析”(資産)
当連結会計年度末の流動資産は、前連結会計年度末に比べて、1,206,125千円増加し、5,396,385千円となりました。これは主として現金及び預金が384,714千円、未収消費税等が697,102千円増加したものの売掛金が108,225千円減少したことなどによるものであります。
当連結会計年度末の固定資産は、前連結会計年度末に比べて、3,764,024千円増加し、13,605,408千円となりました。これは主として、岐阜工場等に係る有形固定資産が3,231,728千円増加したことなどによるものであります。
(負債)
当連結会計年度末の流動負債は、前連結会計年度末に比べて、3,411,873千円増加し、4,728,073千円となりました。これは主として、短期借入金が1,484,300千円、1年内返済予定の長期借入金が1,610,000千円、未払金が246,096千円増加したことなどによるものであります。
当連結会計年度末の固定負債は、前連結会計年度末に比べて、1,674,078千円増加し、10,020,229千円となりました。これは主に、長期借入金が1,065,000千円、リース債務が383,901千円増加したことなどによるものであります。
(純資産)
当連結会計年度末の純資産合計は、前連結会計年度末と比べて、115,802千円減少し、4,253,491千円となりました。これは主に、資本金及び資本準備金がそれぞれ1,804,013千円増加したものの、当期純損失3,717,117千円を計上したことによるものであります。
(4)キャッシュ・フローの状況に関する分析
Section titled “(4)キャッシュ・フローの状況に関する分析”当連結会計年度末における現金及び現金同等物は、前連結会計年度末に比べ384,714千円増加し、4,267,657千円となりました。
(営業活動によるキャッシュ・フロー)
営業活動により支出した資金は、3,578,459千円(前年同期は1,188,134千円の支出)となりました。その主な内訳は、税金等調整前当期純損失4,140,486千円、減価償却費1,404,400千円、利息の支払額227,539千円、助成金の受取額204,264千円であります。
(投資活動によるキャッシュ・フロー)
投資活動により支出した資金は、4,150,619千円(前年同期は8,741,491千円の支出)となりました。その主な内訳は、有形固定資産の取得による支出3,894,139千円、無形固定資産の取得による支出425,671千円であります。
(財務活動によるキャッシュ・フロー)
財務活動により獲得した資金は、8,113,793千円(前年同期は12,360,998千円の獲得)となりました。その主な内訳は、短期借入れによる収入3,386,400千円、短期借入金の返済による支出1,950,000千円、長期借入れによる収入3,025,000千円、株式の発行による収入3,599,274千円であります。
(5)経営成績に重要な影響を与える要因について
Section titled “(5)経営成績に重要な影響を与える要因について”当社は、国内においては、アステラス製薬株式会社と細胞培養インフルエンザワクチンの共同事業化契約を締結しております。また、韓国においては、日東製薬株式会社とUMN-0502、UMN-0501及びUMN-0901に関して「Agreement For The Co-development And Commercialization Of Recombinant Influenza HA Vaccines In South Korea」を締結しております。組換えインフルエンザHAワクチンが上市されるまでの間、これらの契約に従い、一定の開発進捗に応じて対価を収益に計上することになりますが、当該収益に関しては、長期間に渡る組換えインフルエンザHAワクチン開発に係る対価であるため、将来における収益の収受時期及びその額は不確実であり、安定的収益ではありません。また、平成25年12月31日時点におきまして、当社グループは、上記2社以外の製薬企業等との提携契約を締結しておりませんので、当面の収益は当該契約に基づく対価が主な収益となるため、当該開発の進捗状況が当社グループの損益に大きな影響を及ぼします。
(6)経営者の問題認識と今後の方針について
Section titled “(6)経営者の問題認識と今後の方針について”当社グループの経営陣は、当社グループが行っている事業環境について、入手可能な情報と経験に基づいた仮定により、経営判断を行っております。わが国の医療産業においては、医療制度改革に基づく市場環境の変化、ワクチン産業内での競争環境の変化が生じることが予想されております。当社が開発する製品が、これらの環境変化に対応し、市場にて一定のポジションを獲得できるよう、引き続き提携先との共同開発に注力するとともに、供給責任を果たせるよう製造体制のさらなる充実及び製造能力の強化に努めてまいります。
第3 【設備の状況】
Section titled “第3 【設備の状況】”1 【設備投資等の概要】
Section titled “1 【設備投資等の概要】”当連結会計年度における設備投資額は、総額5,276,410千円であり、その主なものは岐阜工場に係る設備であります。
なお、当連結会計年度において重要な設備の除却、売却等はございません。また、当社グループの事業は、医療用医薬品事業及びこれらの付帯事業の単一事業であるため、設備投資等の概要をセグメント別に区別しておりません。
2 【主要な設備の状況】
Section titled “2 【主要な設備の状況】”(1)提出会社
Section titled “(1)提出会社”平成25年12月31日現在
| 事業所名(所在地) | セグメントの名称 | 設備の内容 | 帳簿価額(千円) | 従業員数(名) | |||||
| 建物 | 建物附属設備 | 構築物 | 機械及び装置 | 工具器具備品 | 合計 | ||||
| 横浜本社(神奈川県横浜市西区) | 医薬品の研究開発及び関連する事業 | 本社機能 | ― | 10,393 | ― | ― | 848 | 11,242 | 15 |
| 秋田工場(秋田県秋田市) | 医薬品の研究開発及び関連する事業 | 生産設備 | (注)3383,713 | (注)31,786 | (注)32,348 | (注)38,283 | (注)33,870 | 400,002 | ― |
| 横浜研究所(神奈川県横浜市港北区) | 医薬品の研究開発及び関連する事業 | 研究設備 | ― | 1,958 | ― | 222 | 9,838 | 12,018 | 11 |
| 秋田研究所(秋田県秋田市) | 医薬品の研究開発及び関連する事業 | 研究設備 | ― | ― | ― | ― | 34 | 34 | 3 |
(注) 1.現在休止中の主要な設備はありません。
2.上記の金額には消費税等は含まれておりません。
3.取得価額から圧縮記帳額(建物407,235千円、建物附属設備1,033,324千円、構築物32,257千円、機械及び装置941,546千円、工具器具備品480,124千円)を直接控除しております。
4.秋田工場の従業員数が0名となっておりますが、株式会社UNIGEN従業員13名が従事しております。
5.秋田工場は株式会社UNIGENに賃貸しております。
(2)国内子会社
Section titled “(2)国内子会社”平成25年12月31日現在
| 会社名 | 事業所名(所在地) | セグメントの名称 | 設備の内容 | 帳簿価額(千円) | 従業員数(名) | ||||||
| 建物 | 建物 附属 設備 | 構築物 | 機械 及び 装置 | 工具 器具 備品 | リース資産 | 合計 | |||||
| 株式会社UNIGEN | 秋田本社(秋田県秋田市) | 医薬品の研究開発及び関連する事業 | 生産設備 | ― | 2,388 | 899 | 58,057 | 58,547 | ― | 119,892 | 13 |
| 岐阜工場(岐阜県 揖斐郡 池田町) | 医薬品の研究開発及び関連する事業 | 生産設備 | 2,074,588 | 3,395,931 | 22,214 | 5,901,961 | 98,515 | 629,932 | 12,123,143 | 49 | |
(注) 1.現在休止中の主要な設備はありません。
2.上記のその他以外の金額には消費税等は含まれておりません。
3. 上記の他、連結会社以外から賃借している設備はありません。
3 【設備の新設、除却等の計画】
Section titled “3 【設備の新設、除却等の計画】”(1)重要な設備の新設等
Section titled “(1)重要な設備の新設等”該当事項はありません。
(2)重要な設備の除却等
Section titled “(2)重要な設備の除却等”重要な設備の除却等の計画はありません。
第4 【提出会社の状況】
Section titled “第4 【提出会社の状況】”1 【株式等の状況】
Section titled “1 【株式等の状況】”(1)【株式の総数等】
Section titled “(1)【株式の総数等】”① 【株式の総数】
Section titled “① 【株式の総数】”| 種類 | 発行可能株式総数(株) |
|---|---|
| 普通株式 | 18,000,000 |
| 計 | 18,000,000 |
② 【発行済株式】
Section titled “② 【発行済株式】”| 種類 | 事業年度末現在発行数(株)(平成25年12月31日) | 提出日現在発行数(株)(平成26年3月31日) | 上場金融商品取引所名又は登録認可金融商品取引業協会名 | 内容 |
|---|---|---|---|---|
| 普通株式 | 8,425,900 | 8,449,400 | 東京証券取引所(マザーズ) | 単元株式数は100株であります。 |
| 計 | 8,425,900 | 8,449,400 | ― | ― |
(注) 提出日現在発行数には、平成26年3月1日からこの有価証券報告書提出日までの新株予約権の行使により発行され
た株式数は、含まれておりません。
(2)【新株予約権等の状況】
Section titled “(2)【新株予約権等の状況】”平成13年改正旧商法第280条ノ20及び第280条ノ21の規定に基づき発行した新株予約権は、次のとおりであります。
第4回新株予約権(平成17年7月29日臨時株主総会特別決議に基づく平成18年6月16日取締役会決議)
| 事業年度末現在(平成25年12月31日) | 提出日の前月末現在(平成26年2月28日) | |
|---|---|---|
| 新株予約権の数(個) | 5 (注)1 | 5 (注)1 |
| 新株予約権のうち自己新株予約権の数(個) | ― | ― |
| 新株予約権の目的となる株式の種類 | 普通株式 | 普通株式 |
| 新株予約権の目的となる株式の数(株) | 2,500(注)1、5 | 2,500(注)1、5 |
| 新株予約権の行使時の払込金額(円) | 560(注)2、5 | 560(注)2、5 |
| 新株予約権の行使期間 | 自 平成19年7月29日至 平成27年7月28日 | 自 平成19年7月29日至 平成27年7月28日 |
| 新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額(円) | 発行価格 560資本組入額 280(注)2、5 | 発行価格 560資本組入額 280(注)2、5 |
| 新株予約権の行使の条件 | (注)3 | (注)3 |
| 新株予約権の譲渡に関する事項 | 本新株予約権の譲渡については、取締役会の承認を要する。 | 本新株予約権の譲渡については、取締役会の承認を要する。 |
| 代用払込みに関する事項 | ― | ― |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | (注) 4 | (注) 4 |
(注) 1.新株予約権1個につき目的となる株式数は、事業年度末現在及び提出日の前月末現在、500株であります。
なお、新株予約権発行後、当会社が株式分割または株式併合を行う場合、次の算式により調整するものとする。ただし、かかる調整は、新株予約権のうち、当該時点で行使されていない新株予約権の目的となる株式の数について行われ、調整の結果生じる1株未満の端数については、これを切り捨てるものとし、金銭による調整は行わない。
調整後株式数 = 調整前株式数 × 分割・併合の比率
また、当会社が他社と吸収合併もしくは新設合併を行い、本件新株予約権が継承される場合、または当会社が新設分割もしくは吸収分割を行う場合、当会社は必要と認める株式数の調整を行うものとする。
2.新株予約権発行後、当会社が株式分割または株式併合を行う場合、次の算式により行使価額を調整し、1円未満の端数は切上げる。
| 調整後行使価額 | = | 調整前行使価額 | × | 1 |
| 分割・併合の比率 |
また、当会社が他社と吸収合併もしくは新設合併を行い、本件新株予約権が継承される場合、または当会社が新設分割もしくは吸収分割を行う場合、当会社は必要と認める払込価額の調整を行う。
なお、当会社が行使価額を下回る払込金額で新株の発行または自己株式の処分をするときは、次の算式により行使価額を調整し、調整により生じる1円未満の端数は切上げる。
| 新規発行 | 1株当り払込金額 | |||||||
| 既発行 | × | 調整前 | + | 又は | × | 又は | ||
| 調整後 | = | 株式数 | 行使価額 | 処分株式発行数 | 処分価額 | |||
| 行使価額 | 既発行株式数 + 新規発行株式数又は処分株式数 | |||||||
上記算式において「既発行株式数」とは、当会社の発行株式総数から当会社が保有する自己株式数を控除した数とする。
3.新株予約権の行使の条件は、以下のとおりであります。
(1)新株予約権は、発行時に割当てを受けた新株予約権者において、これを行使することを要する。ただし、相続により新株予約権を取得した場合は、この限りではない。
(2)新株予約権発行時において、当会社の取締役及び従業員であった者は、新株予約権行使時においても当社の役員または従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。
(3)新株予約権行使日において当会社がある証券取引所において上場をしている場合、もしくは1年以内に上場をする見込みである場合、または特定の会社に対する買収が決定している場合であることを要する。
4.組織再編成行為に伴う新株予約権の交付に関する事項は、以下のとおりであります。
当会社が、合併(当会社が合併により消滅する場合に限る。)、吸収分割、新設分割、株式交換または株式移転(以上を総称して以下、「組織再編行為」という。)をする場合において、組織再編行為の効力発生の時点において残存する新株予約権(以下、「残存新株予約権」という。)の新株予約権者に対し、それぞれの場合につき、会社法第236条第1項第8号イからホまでに掲げる株式会社(以下、「再編対象会社」という。)の新株予約権を以下の条件に基づきそれぞれ交付することとする。この場合においては、残存新株予約権は消滅し、再編対象会社は新株予約権を新たに発行するものとする。ただし、以下の条件にそって再編対象会社の新株予約権を交付する旨を、吸収合併契約、新設合併契約、吸収分割契約、新設分割計画、株式交換契約または株式移転計画において定めた場合に限るものとする。
(1)交付する再編対象会社の新株予約権の数
残存新株予約権の新株予約権者が保有する新株予約権の数と同一の数をそれぞれ交付するものとする。
(2)新株予約権の目的である再編対象会社の株式の種類
再編対象会社の普通株式とする。
(3)新株予約権の目的である再編対象会社の株式の数
組織再編行為の条件等を勘案の上、上記1に準じて決定する。
(4)新株予約権の行使に際して出資される財産の価額
交付される各新株予約権の行使に際して出資される財産の価額は、行使価額を組織再編行為の条件等を勘案の上調整して得られる再編後払込金額に上記(3)に従って決定される当該新株予約権の目的である株式の数を乗じて得られる金額とする。
(5)新株予約権を行使することができる期間
新株予約権を行使することができる期間の開始日と組織再編行為の効力発生日のうちいずれか遅い日から、新株予約権を行使することができる期間の満了日までとする。
(6)新株予約権の行使により株式を発行する場合における増加する資本金及び資本準備金に関する事項
①新株予約権の行使により株式を発行する場合における増加する資本金の額は、当該発行価額に0.5を乗じた額とし、計算の結果1円未満の端数を生じる場合は、この端数を切り上げた額とする。
②新株予約権の行使により株式を発行する場合における増加する資本準備金の額は、当該発行価額より上記①に定める増加する資本金の額を減じた額とする。
(7)譲渡による新株予約権の取得の制限
譲渡による新株予約権の取得については、再編対象会社の取締役会の決議による承認を要するものとする。
5.当社は、平成18年9月13日付で1株につき10株、平成23年8月24日付で1株につき50株の割合で株式分割を行っております。これにより、新株予約権の目的となる株式の数、新株予約権の行使時の払込金額、新株予約権の行使により株式を発行する場合の発行価格及び資本組入額が調整されております。
第5回新株予約権(平成17年12月29日臨時株主総会特別決議に基づく平成18年6月16日取締役会決議)
| 事業年度末現在(平成25年12月31日) | 提出日の前月末現在(平成26年2月28日) | |
|---|---|---|
| 新株予約権の数(個) | 52 (注)1 | 15 (注)1 |
| 新株予約権のうち自己新株予約権の数(個) | ― | ― |
| 新株予約権の目的となる株式の種類 | 普通株式 | 普通株式 |
| 新株予約権の目的となる株式の数(株) | 26,000(注)1、4 | 7,500(注)1、4 |
| 新株予約権の行使時の払込金額(円) | 700(注)2、4 | 700(注)2、4 |
| 新株予約権の行使期間 | 自 平成19年12月29日至 平成27年12月28日 | 自 平成19年12月29日至 平成27年12月28日 |
| 新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額(円) | 発行価格 700資本組入額 350(注)2、4 | 発行価格 700資本組入額 350(注)2、4 |
| 新株予約権の行使の条件 | (注)3 | (注)3 |
| 新株予約権の譲渡に関する事項 | 本新株予約権の譲渡については、取締役会の承認を要する。 | 本新株予約権の譲渡については、取締役会の承認を要する。 |
| 代用払込みに関する事項 | ― | ― |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | ― | ― |
(注) 1.新株予約権1個につき目的となる株式数は、事業年度末現在及び提出日の前月末現在、500株であります。
なお、新株予約権発行後、当会社が株式分割または株式併合を行う場合、次の算式により調整するものとする。ただし、かかる調整は、新株予約権のうち、当該時点で行使されていない新株予約権の目的となる株式の数について行われ、調整の結果生じる1株未満の端数については、これを切り捨てるものとする。
調整後株式数 = 調整前株式数 × 分割・併合の比率
また、当会社が他社と吸収合併もしくは新設合併を行い、本件新株予約権が継承される場合、または当会社が新設分割もしくは吸収分割を行う場合、当会社は必要と認める株式数の調整を行うものとする。
2.新株予約権発行後、当会社が株式分割または株式併合を行う場合、次の算式により行使価額を調整し、1円未満の端数は切上げる。
| 調整後行使価額 | = | 調整前行使価額 | × | 1 |
| 分割・併合の比率 |
また、当会社が他社と吸収合併もしくは新設合併を行い、本件新株予約権が継承される場合、または当会社が新設分割もしくは吸収分割を行う場合、当会社は必要と認める払込価額の調整を行う。
なお、当会社が行使価額を下回る払込金額で新株の発行または自己株式の処分をするときは、次の算式により行使価額を調整し、調整により生じる1円未満の端数は切上げる。
| 新規発行 | 1株当り払込金額 | |||||||
| 既発行 | × | 調整前 | + | 又は | × | 又は | ||
| 調整後 | = | 株式数 | 行使価額 | 処分株式発行数 | 処分価額 | |||
| 行使価額 | 既発行株式数 + 新規発行株式数又は処分株式数 | |||||||
上記算式において「既発行株式数」とは、当会社の発行株式総数から当会社が保有する自己株式数を控除した数とする。
3.新株予約権の行使の条件は、以下のとおりであります。
(1)新株予約権は、発行時に割当てを受けた新株予約権者において、これを行使することを要する。ただし、相続により新株予約権を取得した場合は、この限りではない。
(2)新株予約権発行時において、当会社の取締役及び従業員であった者は、新株予約権行使時においても当社の役員または従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。
(3)新株予約権行使日において当会社がある証券取引所において上場をしている場合、もしくは1年以内に上場をする見込みである場合、または特定の会社に対する買収が決定している場合であることを要する。
4.当社は、平成18年9月13日付で1株につき10株、平成23年8月24日付で1株につき50株の割合で株式分割を行っております。これにより、新株予約権の目的となる株式の数、新株予約権の行使時の払込金額、新株予約権の行使により株式を発行する場合の発行価格及び資本組入額が調整されております。
会社法第236条、第238条及び第239条の規定に基づき発行した新株予約権は、次のとおりであります。
第6回新株予約権(平成18年7月12日臨時株主総会決議に基づく平成18年9月22日取締役会決議)
| 事業年度末現在(平成25年12月31日) | 提出日の前月末現在(平成26年2月28日) | |
|---|---|---|
| 新株予約権の数(個) | 106 (注)1 | 96 (注)1 |
| 新株予約権のうち自己新株予約権の数(個) | ― | ― |
| 新株予約権の目的となる株式の種類 | 普通株式 | 普通株式 |
| 新株予約権の目的となる株式の数(株) | 53,000(注)1、5 | 48,000(注)1、5 |
| 新株予約権の行使時の払込金額(円) | 800(注)2、5 | 800(注)2、5 |
| 新株予約権の行使期間 | 自 平成20年9月23日至 平成28年7月12日(注)4 | 自 平成20年9月23日至 平成28年7月12日(注)4 |
| 新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額(円) | 発行価格 800資本組入額 400(注)2、5 | 発行価格 800資本組入額 400(注)2、5 |
| 新株予約権の行使の条件 | (注)3 | (注)3 |
| 新株予約権の譲渡に関する事項 | 本新株予約権の譲渡については、取締役会の承認を要する。 | 本新株予約権の譲渡については、取締役会の承認を要する。 |
| 代用払込みに関する事項 | ― | ― |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | ― | ― |
(注) 1.新株予約権1個につき目的となる株式数は、事業年度末現在及び提出日の前月末現在、500株であります。
なお、新株予約権発行後、当会社が株式分割または株式併合を行う場合、次の算式により調整するものとする。ただし、かかる調整は、新株予約権のうち、当該時点で行使されていない新株予約権の目的となる株式の数について行われ、調整の結果生じる1株未満の端数については、これを切り捨てるものとする。
調整後株式数 = 調整前株式数 × 分割・併合の比率
また、当会社が他社と吸収合併もしくは新設合併を行い、本件新株予約権が継承される場合、または当会社が新設分割もしくは吸収分割を行う場合、当会社は必要と認める株式数の調整を行うものとする。
2.新株予約権発行後、当会社が株式分割または株式併合を行う場合、次の算式により行使価額を調整し、1円未満の端数は切上げる。
| 調整後行使価額 | = | 調整前行使価額 | × | 1 |
| 分割・併合の比率 |
なお、当会社が行使価額を下回る払込金額で新株の発行または自己株式の処分をするとき(新株予約権、新株予約権付社債、その他普通株式の取得を請求できる権利の行使の場合を除く。)は、次の算式により行使価額を調整し、調整により生じる1円未満の端数は切上げる。
| 新規発行 | 1株当り払込金額 | |||||||
| 既発行 | × | 調整前 | + | 又は | × | 又は | ||
| 調整後 | = | 株式数 | 行使価額 | 処分株式発行数 | 処分価額 | |||
| 行使価額 | 既発行株式数 + 新規発行株式数又は処分株式数 | |||||||
上記算式において「既発行株式数」とは、当会社の発行株式総数から当会社が保有する自己株式数を控除した数とする。
3.新株予約権の行使の条件は、以下のとおりであります。
(1)新株予約権は、発行時に割当てを受けた新株予約権者において、これを行使することを要する。ただし、相続により新株予約権を取得した場合は、この限りではない。
(2)新株予約権発行時において、当会社の取締役及び従業員であった者は、新株予約権行使時においても当会社の役員または従業員であることを要する。ただし、任期満了による退任その他正当な理由があると当会社の取締役会で認めた場合ならびに相続により新株予約権を取得した場合は、この限りではない。
(3)新株予約権行使日において当会社がある証券取引所において上場をしている場合、もしくは1年以内に上場をする見込みであると当会社が判断した場合、または特定の会社に買収されることを当会社の株主総会又は取締役会において決定している場合であることを要する。
4.行使期間の最終日が会社の休業日にあたる場合には、その前営業日を最終日とする。
5.当社は、平成23年8月24日付で1株につき50株の割合で株式分割を行っております。これにより、新株予約権の目的となる株式の数、新株予約権の行使時の払込金額、新株予約権の行使により株式を発行する場合の発行価格及び資本組入額が調整されております。
第11回新株予約権(平成22年1月26日臨時株主総会決議に基づく平成22年3月29日取締役会決議)
| 事業年度末現在(平成25年12月31日) | 提出日の前月末現在(平成26年2月28日) | |
|---|---|---|
| 新株予約権の数(個) | 50 (注)1 | 50 (注)1 |
| 新株予約権のうち自己新株予約権の数(個) | ― | ― |
| 新株予約権の目的となる株式の種類 | 普通株式 | 普通株式 |
| 新株予約権の目的となる株式の数(株) | 25,000(注)1、6 | 25,000(注)1、6 |
| 新株予約権の行使時の払込金額(円) | 2,200(注)2、6 | 2,200(注)2、6 |
| 新株予約権の行使期間 | 自 平成24年1月27日至 平成32年1月26日(注)4 | 自 平成24年1月27日至 平成32年1月26日(注)4 |
| 新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額(円) | 発行価格 2,200資本組入額 1,100(注)2、6 | 発行価格 2,200資本組入額 1,100(注)2、6 |
| 新株予約権の行使の条件 | (注)3 | (注)3 |
| 新株予約権の譲渡に関する事項 | 本新株予約権の譲渡については、取締役会の承認を要する。 | 本新株予約権の譲渡については、取締役会の承認を要する。 |
| 代用払込みに関する事項 | ― | ― |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | (注) 5 | (注) 5 |
(注) 1.新株予約権1個につき目的となる株式数は、事業年度末現在及び提出日の前月末現在、500株であります。
なお、新株予約権発行後、当会社が株式分割又は株式併合を行う場合、次の算式により付与株式数を調整するものとする。ただし、かかる調整は、新株予約権のうち、当該時点で行使されていない新株予約権の目的である株式の数について行われ、調整の結果生じる1株未満の端数については、これを切り捨てるものとする。
調整後付与株式数 = 調整前付与株式数 × 分割・併合の比率
2.新株予約権発行後、当会社が株式分割又は株式併合を行う場合、次の算式により行使価額を調整し、1円未満の端数は切り上げる。
| 調整後行使価額 | = | 調整前行使価額 | × | 1 |
| 分割・併合の比率 |
上記のほか、当会社が他社との合併をする場合、会社分割を行う場合、資本減少を行う場合、そのほかこれらの場合に準じ、行使価額の調整を当会社が必要と認めるときは、必要かつ合理的な範囲で、行使価額の調整を行うことができる。
なお、当会社が行使価額を下回る払込金額で新株の発行又は自己株式の処分をするとき(新株予約権の行使により新株式を発行又は交付する場合を除く。)は、次の算式により行使価額を調整し、調整により生じる1円未満の端数は切り上げる。
| 新規発行 | 1株当たり払込金額 | |||||||
| 既発行 | × | 調整前 | + | 又は | × | 又は | ||
| 調整後 | = | 株式数 | 行使価額 | 処分株式発行数 | 処分価額 | |||
| 行使価額 | 既発行株式数 + 新規発行株式数又は処分株式数 | |||||||
上記算式において「既発行株式数」とは、当会社の発行済普通株式総数から当会社が保有する自己株式数を控除した数とする。
3.新株予約権の行使の条件は、以下のとおりであります。
(1)新株予約権は、発行時に割当てを受けた新株予約権者において、これを行使することを要する。ただし、相続により新株予約権を取得した場合は、この限りではない。
(2)新株予約権者は、新株予約権行使時においても当会社の取締役、監査役、執行役又は従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。
(3)新株予約権行使日において当会社がある証券取引所において上場をしている場合、もしくは1年以内に上場をする見込みである場合、又は特定の会社に対する買収が決定している場合であることを要する。
(4)新株予約権者に法令、定款もしくは社内規則に違反する行為があった場合、又は新株予約権者が当会社と競業関係にある相手先の取締役、執行役、監査役、使用人(執行役員を含む。)、嘱託、顧問、社外協力者又はコンサルタントとなった場合等、新株予約権の発行の目的上、新株予約権者に新株予約権を行使させることが相当でないと当会社取締役会が認めた事由が生じた場合は、新株予約権は行使できない。
(5)その他の条件は、株主総会および取締役会の決議に基づき、当会社および被割当者との間で締結する新株予約権割当契約で定めるところによる。
4.行使期間の開始日が当会社の休業日にあたるときはその翌営業日を開始日とし、また行使期間の最終日が当会社の休業日にあたるときは、その前営業日を最終日とする。
5.組織再編成行為に伴う新株予約権の交付に関する事項は、以下のとおりであります。
当会社が、合併(当会社が合併により消滅する場合に限る。)、吸収分割、新設分割、株式交換又は株式移転(以上を総称して以下、「組織再編行為」という。)をする場合において、組織再編行為の効力発生の時点において残存する新株予約権(以下、「残存新株予約権」という。)の新株予約権者に対し、それぞれの場合につき、会社法第236条第1項第8号イからホまでに掲げる株式会社(以下、「再編対象会社」という。)の新株予約権を以下の条件に基づきそれぞれ交付することとする。この場合においては、残存新株予約権は消滅し、再編対象会社は新株予約権を新たに発行するものとする。ただし、以下の条件にそって再編対象会社の新株予約権を交付する旨を、吸収合併契約、新設合併契約、吸収分割契約、新設分割計画、株式交換契約又は株式移転計画において定めた場合に限るものとする。
(1)交付する再編対象会社の新株予約権の数
残存新株予約権の新株予約権者が保有する新株予約権の数と同一の数をそれぞれ交付するものとする。
(2)新株予約権の目的である再編対象会社の株式の種類
再編対象会社の普通株式とする。
(3)新株予約権の目的である再編対象会社の株式の数
組織再編行為の条件等を勘案の上、上記1に準じて決定する。
(4)新株予約権の行使に際して出資される財産の価額
交付される各新株予約権の行使に際して出資される財産の価額は、行使価額を組織再編行為の条件等を勘案の上調整して得られる再編後払込金額に上記(3)に従って決定される当該新株予約権の目的である株式の数を乗じて得られる金額とする。
(5)新株予約権を行使することができる期間
新株予約権を行使することができる期間の開始日と組織再編行為の効力発生日のうちいずれか遅い日から、新株予約権を行使することができる期間の満了日までとする。
(6)新株予約権の行使により株式を発行する場合における増加する資本金および資本準備金に関する事項
①新株予約権の行使により株式を発行する場合における増加する資本金の額は、会社計算規則第40条第1項に従い算出される資本金等増加限度額に0.5を乗じた額とし、計算の結果1円未満の端数を生じる場合は、この端数を切り上げた額とする。
②新株予約権の行使により株式を発行する場合における増加する資本準備金の額は、上記①記載の資本金等増加限度額より上記①に定める増加する資本金の額を減じた額とする。
(7)譲渡による新株予約権の取得の制限
譲渡による新株予約権の取得については、再編対象会社の取締役会の決議による承認を要するものとする。
6.当社は、平成23年8月24日付で1株につき50株の割合で株式分割を行っております。これにより、新株予約権の目的となる株式の数、新株予約権の行使時の払込金額、新株予約権の行使により株式を発行する場合の発行価格及び資本組入額が調整されております。
第13回新株予約権(平成22年1月26日臨時株主総会決議に基づく平成22年7月16日取締役会決議)
| 事業年度末現在(平成25年12月31日) | 提出日の前月末現在(平成26年2月28日) | |
|---|---|---|
| 新株予約権の数(個) | 4 (注)1 | 4 (注)1 |
| 新株予約権のうち自己新株予約権の数(個) | ― | ― |
| 新株予約権の目的となる株式の種類 | 普通株式 | 普通株式 |
| 新株予約権の目的となる株式の数(株) | 2,000(注)1、6 | 2,000(注)1、6 |
| 新株予約権の行使時の払込金額(円) | 2,200(注)2、6 | 2,200(注)2、6 |
| 新株予約権の行使期間 | 自 平成24年1月27日至 平成32年1月26日(注)4 | 自 平成24年1月27日至 平成32年1月26日(注)4 |
| 新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額(円) | 発行価格 2,200資本組入額 1,100(注)2、6 | 発行価格 2,200資本組入額 1,100(注)2、6 |
| 新株予約権の行使の条件 | (注)3 | (注)3 |
| 新株予約権の譲渡に関する事項 | 本新株予約権の譲渡については、取締役会の承認を要する。 | 本新株予約権の譲渡については、取締役会の承認を要する。 |
| 代用払込みに関する事項 | ― | ― |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | (注) 5 | (注) 5 |
(注) 1.新株予約権1個につき目的となる株式数は、事業年度末現在及び提出日の前月末現在、500株であります。
なお、新株予約権発行後、当会社が株式分割又は株式併合を行う場合、次の算式により付与株式数を調整するものとする。ただし、かかる調整は、新株予約権のうち、当該時点で行使されていない新株予約権の目的である株式の数について行われ、調整の結果生じる1株未満の端数については、これを切り捨てるものとする。
調整後付与株式数 = 調整前付与株式数 × 分割・併合の比率
2.新株予約権発行後、当会社が株式分割又は株式併合を行う場合、次の算式により行使価額を調整し、1円未満の端数は切り上げる。
| 調整後行使価額 | = | 調整前行使価額 | × | 1 |
| 分割・併合の比率 |
上記のほか、当会社が他社との合併をする場合、会社分割を行う場合、資本減少を行う場合、そのほかこれらの場合に準じ、行使価額の調整を当会社が必要と認めるときは、必要かつ合理的な範囲で、行使価額の調整を行うことができる。
なお、当会社が行使価額を下回る払込金額で新株の発行又は自己株式の処分をするとき(新株予約権の行使により新株式を発行又は交付する場合を除く。)は、次の算式により行使価額を調整し、調整により生じる1円未満の端数は切り上げる。
| 新規発行 | 1株当たり払込金額 | |||||||
| 既発行 | × | 調整前 | + | 又は | × | 又は | ||
| 調整後 | = | 株式数 | 行使価額 | 処分株式発行数 | 処分価額 | |||
| 行使価額 | 既発行株式数 + 新規発行株式数又は処分株式数 | |||||||
上記算式において「既発行株式数」とは、当会社の発行済普通株式総数から当会社が保有する自己株式数を控除した数とする。
3.新株予約権の行使の条件は、以下のとおりであります。
(1)新株予約権は、発行時に割当てを受けた新株予約権者において、これを行使することを要する。ただし、相続により新株予約権を取得した場合は、この限りではない。
(2)新株予約権発行時において、当会社の従業員であった者は、新株予約権行使時においても当会社又は当会社子会社(会社法第2条第3号に定める子会社を意味する。)の取締役、監査役、執行役又は従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。
(3)新株予約権行使日において当会社がある証券取引所において上場をしている場合、もしくは1年以内に上場をする見込みである場合、又は特定の会社に対する買収が決定している場合であることを要する。
(4)新株予約権者に法令、定款もしくは社内規則に違反する行為があった場合、又は新株予約権者が当会社と競業関係にある相手先の取締役、執行役、監査役、使用人(執行役員を含む。)、嘱託、顧問、社外協力者又はコンサルタントとなった場合等、新株予約権の発行の目的上、新株予約権者に新株予約権を行使させることが相当でないと当会社取締役会が認めた事由が生じた場合は、新株予約権は行使できない。
(5)その他の条件は、株主総会および取締役会の決議に基づき、当会社および被割当者との間で締結する新株予約権割当契約で定めるところによる。
4.行使期間の開始日が当会社の休業日にあたるときはその翌営業日を開始日とし、また行使期間の最終日が当会社の休業日にあたるときは、その前営業日を最終日とする。
5.組織再編成行為に伴う新株予約権の交付に関する事項は、以下のとおりであります。
当会社が、合併(当会社が合併により消滅する場合に限る。)、吸収分割、新設分割、株式交換又は株式移転(以上を総称して以下、「組織再編行為」という。)をする場合において、組織再編行為の効力発生の時点において残存する新株予約権(以下、「残存新株予約権」という。)の新株予約権者に対し、それぞれの場合につき、会社法第236条第1項第8号イからホまでに掲げる株式会社(以下、「再編対象会社」という。)の新株予約権を以下の条件に基づきそれぞれ交付することとする。この場合においては、残存新株予約権は消滅し、再編対象会社は新株予約権を新たに発行するものとする。ただし、以下の条件にそって再編対象会社の新株予約権を交付する旨を、吸収合併契約、新設合併契約、吸収分割契約、新設分割計画、株式交換契約又は株式移転計画において定めた場合に限るものとする。
(1)交付する再編対象会社の新株予約権の数
残存新株予約権の新株予約権者が保有する新株予約権の数と同一の数をそれぞれ交付するものとする。
(2)新株予約権の目的である再編対象会社の株式の種類
再編対象会社の普通株式とする。
(3)新株予約権の目的である再編対象会社の株式の数
組織再編行為の条件等を勘案の上、上記1に準じて決定する。
(4)新株予約権の行使に際して出資される財産の価額
交付される各新株予約権の行使に際して出資される財産の価額は、行使価額を組織再編行為の条件等を勘案の上調整して得られる再編後払込金額に上記(3)に従って決定される当該新株予約権の目的である株式の数を乗じて得られる金額とする。
(5)新株予約権を行使することができる期間
新株予約権を行使することができる期間の開始日と組織再編行為の効力発生日のうちいずれか遅い日から、新株予約権を行使することができる期間の満了日までとする。
(6)新株予約権の行使により株式を発行する場合における増加する資本金および資本準備金に関する事項
①新株予約権の行使により株式を発行する場合における増加する資本金の額は、会社計算規則第17条第1項に従い算出される資本金等増加限度額に0.5を乗じた額とし、計算の結果1円未満の端数を生じる場合は、この端数を切り上げた額とする。
②新株予約権の行使により株式を発行する場合における増加する資本準備金の額は、上記①記載の資本金等増加限度額より上記①に定める増加する資本金の額を減じた額とする。
(7)譲渡による新株予約権の取得の制限
譲渡による新株予約権の取得については、再編対象会社の取締役会の決議による承認を要するものとする。
6.当社は、平成23年8月24日付で1株につき50株の割合で株式分割を行っております。これにより、新株予約権の目的となる株式の数、新株予約権の行使時の払込金額、新株予約権の行使により株式を発行する場合の発行価格及び資本組入額が調整されております。
第14回新株予約権(平成22年1月26日臨時株主総会決議に基づく平成22年8月13日取締役会決議)
| 事業年度末現在(平成25年12月31日) | 提出日の前月末現在(平成26年2月28日) | |
|---|---|---|
| 新株予約権の数(個) | 9(注)1 | 9(注)1 |
| 新株予約権のうち自己新株予約権の数(個) | ― | ― |
| 新株予約権の目的となる株式の種類 | 普通株式 | 普通株式 |
| 新株予約権の目的となる株式の数(株) | 4,500(注)1、6 | 4,500(注)1、6 |
| 新株予約権の行使時の払込金額(円) | 2,200(注)2、6 | 2,200(注)2、6 |
| 新株予約権の行使期間 | 自 平成24年1月27日至 平成32年1月26日(注)4 | 自 平成24年1月27日至 平成32年1月26日(注)4 |
| 新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額(円) | 発行価格 2,200資本組入額 1,100(注)2、6 | 発行価格 2,200資本組入額 1,100(注)2、6 |
| 新株予約権の行使の条件 | (注)3 | (注)3 |
| 新株予約権の譲渡に関する事項 | 本新株予約権の譲渡については、取締役会の承認を要する。 | 本新株予約権の譲渡については、取締役会の承認を要する。 |
| 代用払込みに関する事項 | ― | ― |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | (注) 5 | (注) 5 |
(注) 1.新株予約権1個につき目的となる株式数は、事業年度末現在及び提出日の前月末現在、500株であります。
なお、新株予約権発行後、当会社が株式分割又は株式併合を行う場合、次の算式により付与株式数を調整するものとする。ただし、かかる調整は、新株予約権のうち、当該時点で行使されていない新株予約権の目的である株式の数について行われ、調整の結果生じる1株未満の端数については、これを切り捨てるものとする。
調整後付与株式数 = 調整前付与株式数 × 分割・併合の比率
2.新株予約権発行後、当会社が株式分割又は株式併合を行う場合、次の算式により行使価額を調整し、1円未満の端数は切り上げる。
| 調整後行使価額 | = | 調整前行使価額 | × | 1 |
| 分割・併合の比率 |
上記のほか、当会社が他社との合併をする場合、会社分割を行う場合、資本減少を行う場合、そのほかこれらの場合に準じ、行使価額の調整を当会社が必要と認めるときは、必要かつ合理的な範囲で、行使価額の調整を行うことができる。
なお、当会社が行使価額を下回る払込金額で新株の発行又は自己株式の処分をするとき(新株予約権の行使により新株式を発行又は交付する場合を除く。)は、次の算式により行使価額を調整し、調整により生じる1円未満の端数は切り上げる。
| 新規発行 | 1株当たり払込金額 | |||||||
| 既発行 | × | 調整前 | + | 又は | × | 又は | ||
| 調整後 | = | 株式数 | 行使価額 | 処分株式発行数 | 処分価額 | |||
| 行使価額 | 既発行株式数 + 新規発行株式数又は処分株式数 | |||||||
上記算式において「既発行株式数」とは、当会社の発行済普通株式総数から当会社が保有する自己株式数を控除した数とする。
3.新株予約権の行使の条件は、以下のとおりであります。
(1)新株予約権は、発行時に割当てを受けた新株予約権者において、これを行使することを要する。ただし、相続により新株予約権を取得した場合は、この限りではない。
(2)新株予約権発行時において、当会社の従業員であった者は、新株予約権行使時においても当会社又は当会社子会社(会社法第2条第3号に定める子会社を意味する。)の取締役、監査役、執行役又は従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。
(3)新株予約権行使日において当会社がある証券取引所において上場をしている場合、もしくは1年以内に上場をする見込みである場合、又は特定の会社に対する買収が決定している場合であることを要する。
(4)新株予約権者に法令、定款もしくは社内規則に違反する行為があった場合、又は新株予約権者が当会社と競業関係にある相手先の取締役、執行役、監査役、使用人(執行役員を含む。)、嘱託、顧問、社外協力者又はコンサルタントとなった場合等、新株予約権の発行の目的上、新株予約権者に新株予約権を行使させることが相当でないと当会社取締役会が認めた事由が生じた場合は、新株予約権は行使できない。
(5)その他の条件は、株主総会および取締役会の決議に基づき、当会社および被割当者との間で締結する新株予約権割当契約で定めるところによる。
4.行使期間の開始日が当会社の休業日にあたるときはその翌営業日を開始日とし、また行使期間の最終日が当会社の休業日にあたるときは、その前営業日を最終日とする。
5.組織再編成行為に伴う新株予約権の交付に関する事項は、以下のとおりであります。
当会社が、合併(当会社が合併により消滅する場合に限る。)、吸収分割、新設分割、株式交換又は株式移転(以上を総称して以下、「組織再編行為」という。)をする場合において、組織再編行為の効力発生の時点において残存する新株予約権(以下、「残存新株予約権」という。)の新株予約権者に対し、それぞれの場合につき、会社法第236条第1項第8号イからホまでに掲げる株式会社(以下、「再編対象会社」という。)の新株予約権を以下の条件に基づきそれぞれ交付することとする。この場合においては、残存新株予約権は消滅し、再編対象会社は新株予約権を新たに発行するものとする。ただし、以下の条件にそって再編対象会社の新株予約権を交付する旨を、吸収合併契約、新設合併契約、吸収分割契約、新設分割計画、株式交換契約又は株式移転計画において定めた場合に限るものとする。
(1)交付する再編対象会社の新株予約権の数
残存新株予約権の新株予約権者が保有する新株予約権の数と同一の数をそれぞれ交付するものとする。
(2)新株予約権の目的である再編対象会社の株式の種類
再編対象会社の普通株式とする。
(3)新株予約権の目的である再編対象会社の株式の数
組織再編行為の条件等を勘案の上、上記1に準じて決定する。
(4)新株予約権の行使に際して出資される財産の価額
交付される各新株予約権の行使に際して出資される財産の価額は、行使価額を組織再編行為の条件等を勘案の上調整して得られる再編後払込金額に上記(3)に従って決定される当該新株予約権の目的である株式の数を乗じて得られる金額とする。
(5)新株予約権を行使することができる期間
新株予約権を行使することができる期間の開始日と組織再編行為の効力発生日のうちいずれか遅い日から、新株予約権を行使することができる期間の満了日までとする。
(6)新株予約権の行使により株式を発行する場合における増加する資本金および資本準備金に関する事項
①新株予約権の行使により株式を発行する場合における増加する資本金の額は、会社計算規則第17条第1項に従い算出される資本金等増加限度額に0.5を乗じた額とし、計算の結果1円未満の端数を生じる場合は、この端数を切り上げた額とする。
②新株予約権の行使により株式を発行する場合における増加する資本準備金の額は、上記①記載の資本金等増加限度額より上記①に定める増加する資本金の額を減じた額とする。
(7)譲渡による新株予約権の取得の制限
譲渡による新株予約権の取得については、再編対象会社の取締役会の決議による承認を要するものとする。
6.当社は、平成23年8月24日付で1株につき50株の割合で株式分割を行っております。これにより、新株予約権の目的となる株式の数、新株予約権の行使時の払込金額、新株予約権の行使により株式を発行する場合の発行価格及び資本組入額が調整されております。
第15回新株予約権(平成22年1月26日臨時株主総会決議に基づく平成22年8月31日取締役会決議)
| 事業年度末現在(平成25年12月31日) | 提出日の前月末現在(平成26年2月28日) | |
|---|---|---|
| 新株予約権の数(個) | 10 (注)1 | 10 (注)1 |
| 新株予約権のうち自己新株予約権の数(個) | ― | ― |
| 新株予約権の目的となる株式の種類 | 普通株式 | 普通株式 |
| 新株予約権の目的となる株式の数(株) | 5,000(注)1、6 | 5,000(注)1、6 |
| 新株予約権の行使時の払込金額(円) | 2,200(注)2、6 | 2,200(注)2、6 |
| 新株予約権の行使期間 | 自 平成24年1月27日至 平成32年1月26日(注)4 | 自 平成24年1月27日至 平成32年1月26日(注)4 |
| 新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額(円) | 発行価格 2,200資本組入額 1,100(注)2、6 | 発行価格 2,200資本組入額 1,100(注)2、6 |
| 新株予約権の行使の条件 | (注)3 | (注)3 |
| 新株予約権の譲渡に関する事項 | 本新株予約権の譲渡については、取締役会の承認を要する。 | 本新株予約権の譲渡については、取締役会の承認を要する。 |
| 代用払込みに関する事項 | ― | ― |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | (注) 5 | (注) 5 |
(注) 1.新株予約権1個につき目的となる株式数は、事業年度末現在及び提出日の前月末現在、500株であります。
なお、新株予約権発行後、当会社が株式分割又は株式併合を行う場合、次の算式により付与株式数を調整するものとする。ただし、かかる調整は、新株予約権のうち、当該時点で行使されていない新株予約権の目的である株式の数について行われ、調整の結果生じる1株未満の端数については、これを切り捨てるものとする。
調整後付与株式数 = 調整前付与株式数 × 分割・併合の比率
2.新株予約権発行後、当会社が株式分割又は株式併合を行う場合、次の算式により行使価額を調整し、1円未満の端数は切り上げる。
| 調整後行使価額 | = | 調整前行使価額 | × | 1 |
| 分割・併合の比率 |
上記のほか、当会社が他社との合併をする場合、会社分割を行う場合、資本減少を行う場合、そのほかこれらの場合に準じ、行使価額の調整を当会社が必要と認めるときは、必要かつ合理的な範囲で、行使価額の調整を行うことができる。
なお、当会社が行使価額を下回る払込金額で新株の発行又は自己株式の処分をするとき(新株予約権の行使により新株式を発行又は交付する場合を除く。)は、次の算式により行使価額を調整し、調整により生じる1円未満の端数は切り上げる。
| 新規発行 | 1株当たり払込金額 | |||||||
| 既発行 | × | 調整前 | + | 又は | × | 又は | ||
| 調整後 | = | 株式数 | 行使価額 | 処分株式発行数 | 処分価額 | |||
| 行使価額 | 既発行株式数 + 新規発行株式数又は処分株式数 | |||||||
上記算式において「既発行株式数」とは、当会社の発行済普通株式総数から当会社が保有する自己株式数を控除した数とする。
3.新株予約権の行使の条件は、以下のとおりであります。
(1)新株予約権は、発行時に割当てを受けた新株予約権者において、これを行使することを要する。ただし、相続により新株予約権を取得した場合は、この限りではない。
(2)新株予約権者は、新株予約権行使時においても当会社の取締役、監査役、執行役又は従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。
(3)新株予約権行使日において当会社がある証券取引所において上場をしている場合、もしくは1年以内に上場をする見込みである場合、又は特定の会社に対する買収が決定している場合であることを要する。
(4)新株予約権者に法令、定款もしくは社内規則に違反する行為があった場合、又は新株予約権者が当会社と競業関係にある相手先の取締役、執行役、監査役、使用人(執行役員を含む。)、嘱託、顧問、社外協力者又はコンサルタントとなった場合等、新株予約権の発行の目的上、新株予約権者に新株予約権を行使させることが相当でないと当会社取締役会が認めた事由が生じた場合は、新株予約権は行使できない。
(5)その他の条件は、株主総会および取締役会の決議に基づき、当会社および被割当者との間で締結する新株予約権割当契約で定めるところによる。
4.行使期間の開始日が当会社の休業日にあたるときはその翌営業日を開始日とし、また行使期間の最終日が当会社の休業日にあたるときは、その前営業日を最終日とする。
5.組織再編成行為に伴う新株予約権の交付に関する事項は、以下のとおりであります。
当会社が、合併(当会社が合併により消滅する場合に限る。)、吸収分割、新設分割、株式交換又は株式移転(以上を総称して以下、「組織再編行為」という。)をする場合において、組織再編行為の効力発生の時点において残存する新株予約権(以下、「残存新株予約権」という。)の新株予約権者に対し、それぞれの場合につき、会社法第236条第1項第8号イからホまでに掲げる株式会社(以下、「再編対象会社」という。)の新株予約権を以下の条件に基づきそれぞれ交付することとする。この場合においては、残存新株予約権は消滅し、再編対象会社は新株予約権を新たに発行するものとする。ただし、以下の条件にそって再編対象会社の新株予約権を交付する旨を、吸収合併契約、新設合併契約、吸収分割契約、新設分割計画、株式交換契約又は株式移転計画において定めた場合に限るものとする。
(1)交付する再編対象会社の新株予約権の数
残存新株予約権の新株予約権者が保有する新株予約権の数と同一の数をそれぞれ交付するものとする。
(2)新株予約権の目的である再編対象会社の株式の種類
再編対象会社の普通株式とする。
(3)新株予約権の目的である再編対象会社の株式の数
組織再編行為の条件等を勘案の上、上記1に準じて決定する。
(4)新株予約権の行使に際して出資される財産の価額
交付される各新株予約権の行使に際して出資される財産の価額は、行使価額を組織再編行為の条件等を勘案の上調整して得られる再編後払込金額に上記(3)に従って決定される当該新株予約権の目的である株式の数を乗じて得られる金額とする。
(5)新株予約権を行使することができる期間
新株予約権を行使することができる期間の開始日と組織再編行為の効力発生日のうちいずれか遅い日から、新株予約権を行使することができる期間の満了日までとする。
(6)新株予約権の行使により株式を発行する場合における増加する資本金および資本準備金に関する事項
①新株予約権の行使により株式を発行する場合における増加する資本金の額は、会社計算規則第17条第1項に従い算出される資本金等増加限度額に0.5を乗じた額とし、計算の結果1円未満の端数を生じる場合は、この端数を切り上げた額とする。
②新株予約権の行使により株式を発行する場合における増加する資本準備金の額は、上記①記載の資本金等増加限度額より上記①に定める増加する資本金の額を減じた額とする。
(7)譲渡による新株予約権の取得の制限
譲渡による新株予約権の取得については、再編対象会社の取締役会の決議による承認を要するものとする。
6.当社は、平成23年8月24日付で1株につき50株の割合で株式分割を行っております。これにより、新株予約権の目的となる株式の数、新株予約権の行使時の払込金額、新株予約権の行使により株式を発行する場合の発行価格及び資本組入額が調整されております。
第18回新株予約権(平成25年10月17日発行)
| 事業年度末現在(平成25年12月31日) | 提出日の前月末現在(平成26年2月28日) | |
|---|---|---|
| 新株予約権の数(個) | 4,884 | 4,884 |
| 新株予約権のうち自己新株予約権の数(個) | ― | ― |
| 新株予約権の目的となる株式の種類 | 普通株式 | 普通株式 |
| 新株予約権の目的となる株式の数(株) | 488,400 | 488,400 |
| 新株予約権の行使時の払込金額(円) | 1,280 | 1,280 |
| 新株予約権の行使期間 | 自 平成25年10月18日至 平成28年10月17日 | 自 平成25年10月18日至 平成28年10月17日 |
| 新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額(円) | 発行価格 3,807資本組入額 1,903.5 | 発行価格 3,807資本組入額 1,903.5 |
| 新株予約権の行使の条件 | 各本新株予約権の一部行使はできないものとする。 | 各本新株予約権の一部行使はできないものとする。 |
| 新株予約権の譲渡に関する事項 | 本新株予約権の譲渡については、取締役会の承認を要する。 | 本新株予約権の譲渡については、取締役会の承認を要する。 |
| 代用払込みに関する事項 | ― | ― |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | ― | ― |
(注) 1.本新株予約権は、行使価額修正条項付新株予約権付社債券等であります。当該行使価額修正条項付新株予約権付社債券等の特質等は以下のとおりであります。
(1) 本新株予約権は、潜在株式数が1,000,000株と一定でありますが、株価の下落局面では、行使価額が下方修正されることにより、資金調達の額が減少する可能性があります。ただし、行使価額は下限行使価額を下回ることはありません。
( (2) 行使価額の修正の基準及び頻度
① 行使価額の修正基準
本新株予約権の行使価額は、各行使請求の通知が行われた日の直前取引日の株式会社東京証券取引所(以下「東証」という。)終値を基準として修正されます。
② 行使価額の修正頻度
行使の都度、上記(2)①行使価額の修正基準に記載のとおり修正されます。
(3) 行使価額の下限及び新株予約権の目的となる株式の数の上限
① 行使価額の下限:3,807円
② 新株予約権の目的となる株式の数の上限:1,000,000株
③ 資金調達の下限:本新株予約権がすべて行使された場合の資金調達額の下限(上記①に記載の行使価額の下限にて本新株予約権がすべて行使された場合の資金調達額):3,807,000,000円(ただし、本新株予約権は行使されない可能性があります。)
(4) 本新株予約権には、当社の決定により残存する本新株予約権の全部の取得を可能とする旨の条項が設けられております。また、平成28年8月31日までの間のいずれかの5連続取引日の東証終値のすべてが下限行使価額を下回った場合、または平成28年9月1日以降はいつでも、割当先は当社に対して通知することにより、本新株予約権の取得を請求することができ、かかる請求がなされた場合、当社は、新株予約権の払込金額と同額の金銭を支払うことにより本新株予約権を取得する条項が設けられております。
(5) 本新株予約権に表示された権利の行使に関する事項について本新株予約権の割当先との間の取決めの内容
当社は割当先との間で、以下の内容を含んだ本新株予約権買取契約を締結しております。
① 当社による行使指定
平成25年10月18日以降、平成28年7月29日までの間において、当社の判断により、当社は割当先に対して本新株予約権を行使すべき旨及び行使すべき本新株予約権の数を指定することができます(以下「行使指定」という。)。
行使に際しては、以下の要件を持たすことが前提となります。
(ⅰ) 行使してを行った日(以下「行使指定日」という。)の東証終値が下限行使価額の110%の水準を下回っていないこと
(ⅱ) 前回の行使指定日から20取引日以上の間隔が空いていること
(ⅲ) 当社が未公表の重要事実を認識していないこと
(ⅳ) 当社株価に重大な影響を及ぼす事実の開示を行った日及びその翌取引日でないこと
(ⅴ) 割当先が本新株予約権の全部または一部につき、行使することができない期間の指定が行われていないこと
(ⅵ) 当社普通株式の普通取引が東証の定める株券の呼値の制限値幅の上限に達し(ストップ高)または下限に達した(ストップ安)まま終了していないこと
当社が行使指定を行った場合、割当先は、原則として、行使指定日の翌取引日から20取引日(以下「指定行使期間という。)以内に指定された数の本新株予約権を行使する義務を負います。
一度に行使指定可能な本新株予約権には限度があり、本新株予約権の行使により交付されることとなる当社株式の数が行使指定日の前取引日までの20取引日または60取引日における当社株式の1日あたり平均出来高の最も少ない方に2を乗じて得られる数と791,430株(発行決議日現在の発行済株式数に同日決議の第三者割当増資に係る新株式発行により発行された株式の数を加えた株数の10%に相当する株数)のいずれか小さい方を超えないように指定する必要があります。
ただし、行使指定後、当該行使指定に係る行使指定期間中に東証終値が下限行使価額を下回った場合には、以後、当該行使指定の効力は失われます。
当社は、行使指定を行う際にはその旨をプレスリリースにて開示します。
② 当社により行使停止
当社は、行使価額修正開始日以降、平成28年10月14日までの間において、割当先が本新株予約権の全部または一部につき、行使することができない期間(以下「停止指定期間」という。)を指定(以下「停止指定」という。)することができます(ただし、上記①の行使指定を受けて割当先が行使義務を負っている本新株予約権の行使を妨げるような停止指定行うことはできません。)。
なお、当社は、一旦行った停止指定をいつでも取消すことができます。
停止指定を行う際には、停止指定を行った旨及び停止して期間を、また停止指定を取消す際にはその旨をプレスリリースにて開示いたします。
(3)【行使価額修正条項付新株予約権付社債券等の行使状況等】
Section titled “(3)【行使価額修正条項付新株予約権付社債券等の行使状況等】”| 第4四半期会計期間(平成25年10月1日から 平成25年12月31日まで) | 第10期(平成25年1月1日から 平成25年12月31日まで) | |
|---|---|---|
| 当該期間に権利行使された当該行使価額修正条項付新株予約権付社債券等の数(個) | 5,116 | 5,116 |
| 当該期間の権利行使に係る交付株式数(株) | 511,600 | 511,600 |
| 当該期間の権利行使に係る平均行使価額等(円) | 3,807 | 3,807 |
| 当該期間の権利行使に係る資金調達額(千円) | 1,947,661 | 1,947,661 |
| 当該期間の末日における権利行使された当該行使価額修正条項付新株予約権付社債券等の数の累計(個) | 5,116 | 5,116 |
| 当該期間の末日における当該行使価額修正条項付新株予約権付社債券等に係る累計の交付株式数(株) | 511,600 | 511,600 |
| 当該期間の末日における当該行使価額修正条項付新株予約権付社債券等に係る累計の平均行使価額等(円) | 3,807 | 3,807 |
| 当該期間の末日における当該行使価額修正条項付新株予約権付社債券等に係る累計の資金調達額(千円) | 1,947,661 | 1,947,661 |
(4)【ライツプランの内容】
Section titled “(4)【ライツプランの内容】”該当事項はありません。
(5)【発行済株式総数、資本金等の推移】
Section titled “(5)【発行済株式総数、資本金等の推移】”| 年月日 | 発行済株式総数増減数(株) | 発行済株式総数残高(株) | 資本金増減額 (千円) | 資本金残高 (千円) | 資本準備金増減額(千円) | 資本準備金残高(千円) |
|---|---|---|---|---|---|---|
| 平成21年2月13日(注)1 | 1,418 | 75,057 | 99,969 | 2,073,700 | 99,969 | 1,742,700 |
| 平成22年1月28日(注)2 | 4,545 | 79,602 | 249,975 | 2,323,675 | 249,975 | 1,992,675 |
| 平成22年5月28日(注)3 | 2,928 | 82,530 | 161,040 | 2,484,715 | 161,040 | 2,153,715 |
| 平成22年12月29日(注)4 | 2,702 | 85,232 | 249,935 | 2,734,650 | 249,935 | 2,403,650 |
| 平成23年3月8日(注)5 | 5,100 | 90,332 | 471,750 | 3,206,400 | 471,750 | 2,875,400 |
| 平成23年8月24日(注)6 | 4,426,268 | 4,516,600 | ― | 3,206,400 | ― | 2,875,400 |
| 平成24年8月21日(注)7 | 270,100 | 4,786,700 | 499,685 | 3,706,085 | 499,685 | 3,375,085 |
| 平成24年12月10日(注)8 | 2,150,000 | 6,936,700 | 1,285,700 | 4,991,785 | 1,285,700 | 4,660,785 |
| 平成24年12月27日(注)9 | 268,500 | 7,205,200 | 160,563 | 5,152,348 | 160,563 | 4,821,348 |
| 平成25年10月17日(注)10 | 262,600 | 7,467,800 | 499,859 | 5,652,207 | 499,859 | 5,321,207 |
| 平成25年1月1日~ 平成25年12月31日(注)11 | 958,100 | 8,425,900 | 1,304,154 | 6,956,361 | 1,304,154 | 6,625,361 |
(注) 1. 有償第三者割当
発行価格 141,000円
資本組入額 70,500円
割当先 株式会社IHIプラントエンジニアリング
2. 有償第三者割当
発行価格 110,000円
資本組入額 55,000円
割当先 株式会社IHI
3. 有償第三者割当
発行価格 110,000円
資本組入額 55,000円
割当先 株式会社IHI、アピ株式会社 他1名
4. 有償第三者割当
発行価格 185,000円
資本組入額 92,500円
割当先 株式会社IHI
5. 有償第三者割当
発行価格 185,000円
資本組入額 92,500円
割当先 アピ株式会社
6. 株式分割(無償交付)
分割の割合 1株につき50株の割合
7. 有償第三者割当
発行価格 3,700円
資本組入額 1,850円
割当先 アピ株式会社 他4名
8. 有償一般募集(ブックビルディング方式)
発行価格 1,300円 引受価額 1,196円
発行価額 1,105円 資本組入額 598円
9. 有償第三者割当
発行価格 1,196円
資本組入額 598円
割当先 野村證券株式会社
10. 有償第三者割当
発行価格 3,807円
資本組入額 1,903.5円
割当先 アステラス製薬株式会社
11. 新株予約権の権利行使による増加であります。
12. 平成26年1月1日から平成26年2月28日までの間に、新株予約権の行使により、発行済株式総数が23,500
株、資本金が8,475千円及び資本準備金が8,475千円増加しております。
(6)【所有者別状況】
Section titled “(6)【所有者別状況】”平成25年12月31日現在
| 区分 | 株式の状況(1単元の株式数100株) | 単元未満株式の状況(株) | |||||||
| 政府及び地方公共団体 | 金融機関 | 金融商品取引業者 | その他の法人 | 外国法人等 | 個人その他 | 計 | |||
| 個人以外 | 個人 | ||||||||
| 株主数(人) | ― | 11 | 34 | 70 | 66 | 12 | 6,813 | 7,006 | ― |
| 所有株式数(単元) | ― | 13,261 | 5,923 | 13,982 | 7,930 | 92 | 43,038 | 84,226 | 3,300 |
| 所有株式数の割合(%) | 0.00 | 15.75 | 7.03 | 16.60 | 9.41 | 0.11 | 51.10 | 100.00 | ― |
(7)【大株主の状況】
Section titled “(7)【大株主の状況】”平成25年12月31日現在
| 氏名又は名称 | 住所 | 所有株式数(株) | 発行済株式総数に対する所有株式数の割合(%) |
|---|---|---|---|
| 日本マスタートラスト信託銀行 株式会社(信託口) | 東京都港区浜松町2-11-3 | 476,000 | 5.64 |
| 株式会社IHI | 東京都江東区豊洲3-1-1 | 453,250 | 5.37 |
| アピ株式会社 | 岐阜県岐阜市加納桜田町1-1 | 400,000 | 4.74 |
| 日本トラスティ・サービス 信託銀行株式会社(信託口) | 東京都中央区晴海1-8-11 | 279,700 | 3.31 |
| アステラス製薬株式会社 | 東京都中央区日本橋本町2-5-1 | 262,600 | 3.11 |
| 坂本 寿章 | 島根県雲南市 | 161,100 | 1.91 |
| 京大ベンチャーNVCC1号投資事業有限責任組合 | 東京都港区赤坂7-1-16 | 159,000 | 1.88 |
| エムエルピーエフエス カストディー アカウント | 東京都中央区日本橋1-4-1 日本橋一丁目ビルディング | 149,000 | 1.76 |
| 株式会社IHIプラントエンジニアリング | 東京都江東区豊洲3-1-1 | 141,800 | 1.68 |
| 日本トラスティ・サービス 信託銀行株式会社(信託口9) | 東京都中央区晴海1-8-11 | 131,400 | 1.55 |
| 計 | ― | 2,613,850 | 30.95 |
(注) 野村證券株式会社及びその共同保有者であるNOMURA INTERNATIONAL PLCから平成25年12月2日付で提出された大量
保有報告書により、平成25年12月13日現在で以下の株式を保有している旨の報告を受けておりますが、当社とし
て当事業年度末時点における実質所有株式数の確認ができませんので、上記大株主の状況には含めておりません。
なお、大量保有報告書の内容は以下のとおりであります。
| 氏名又は名称 | 住所 | 保有株券等の数(株) | 株券等保有割合(%) |
|---|---|---|---|
| 野村證券株式会社 | 東京都中央区日本橋一丁目9番1号 | 663,700 | 7.45 |
| NOMURA INTERNATIONAL PLC | 1 Angel Lane,London EC4R 3AB, United Kingdom | 63,200 | 0.75 |
(8)【議決権の状況】
Section titled “(8)【議決権の状況】”① 【発行済株式】
Section titled “① 【発行済株式】”平成25年12月31日現在
| 区分 | 株式数(株) | 議決権の数(個) | 内容 |
|---|---|---|---|
| 無議決権株式 | ― | ― | ― |
| 議決権制限株式(自己株式等) | ― | ― | ― |
| 議決権制限株式(その他) | ― | ― | ― |
| 完全議決権株式(自己株式等) | ― | ― | ― |
| 完全議決権株式(その他) | 普通株式 8,422,600 | 84,226 | 権利内容に何ら制限のない当社における標準となる株式であります。単元株式数 100株 |
| 単元未満株式 | 普通株式 3,300 | ― | ― |
| 発行済株式総数 | 8,425,900 | ― | ― |
| 総株主の議決権 | ― | 84,226 | ― |
(注) 「単元未満株式」欄の普通株式には、当社所有の自己株式が50株含まれております。
② 【自己株式等】
Section titled “② 【自己株式等】”平成25年12月31日現在
| 所有者の氏名又は名称 | 所有者の住所 | 自己名義所有株式数(株) | 他人名義所有株式数(株) | 所有株式数の合計(株) | 発行済株式総数に対する所有株式数の割合(%) |
|---|---|---|---|---|---|
| ― | ― | ― | ― | ― | ― |
| 計 | ― | ― | ― | ― | ― |
(9)【ストック・オプション制度の内容】
Section titled “(9)【ストック・オプション制度の内容】”当社は、新株予約権方式によるストック・オプション制度を採用しております。当該制度は、旧商法第280条ノ20及び第280条ノ21の規定、会社法第236条、第238条及び第239条の規定に基づき、新株予約権を付与する方式により、当社の取締役、監査役、従業員及び社外協力者に対して新株予約権を付与することを下記株主総会及び取締役会において決議されたものであります。当該制度の内容は、次のとおりであります。
①旧商法第280条ノ20及び第280条ノ21の規定に基づく新株予約権
Section titled “①旧商法第280条ノ20及び第280条ノ21の規定に基づく新株予約権”(第4回新株予約権)
| 決議年月日 | 平成17年7月29日 臨時株主総会特別決議(平成18年6月16日 取締役会決議) |
|---|---|
| 付与対象者の区分及び人数(名) | 当社従業員1名、社外協力者1名 |
| 新株予約権の目的となる株式の種類 | 「(2)新株予約権等の状況」に記載しております。 |
| 株式の数 | 同上 |
| 新株予約権の行使時の払込金額 | 同上 |
| 新株予約権の行使期間 | 同上 |
| 新株予約権の行使の条件 | 同上 |
| 新株予約権の譲渡に関する事項 | 同上 |
| 代用払込みに関する事項 | 同上 |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | 同上 |
(第5回新株予約権)
| 決議年月日 | 平成17年12月29日 臨時株主総会特別決議(平成18年6月16日 取締役会決議) |
|---|---|
| 付与対象者の区分及び人数(名) | 当社取締役6名、当社監査役1名、当社従業員6名、社外協力者2名 |
| 新株予約権の目的となる株式の種類 | 「(2)新株予約権等の状況」に記載しております。 |
| 株式の数 | 同上 |
| 新株予約権の行使時の払込金額 | 同上 |
| 新株予約権の行使期間 | 同上 |
| 新株予約権の行使の条件 | 同上 |
| 新株予約権の譲渡に関する事項 | 同上 |
| 代用払込みに関する事項 | 同上 |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | 同上 |
②会社法第236条、第238条及び第239条の規定に基づく新株予約権
Section titled “②会社法第236条、第238条及び第239条の規定に基づく新株予約権”(第6回新株予約権)
| 決議年月日 | 平成18年7月12日 臨時株主総会決議(平成18年9月22日 取締役会決議) |
|---|---|
| 付与対象者の区分及び人数(名) | 当社取締役5名、当社監査役3名、当社従業員10名、社外協力者3名 |
| 新株予約権の目的となる株式の種類 | 「(2)新株予約権等の状況」に記載しております。 |
| 株式の数 | 同上 |
| 新株予約権の行使時の払込金額 | 同上 |
| 新株予約権の行使期間 | 同上 |
| 新株予約権の行使の条件 | 同上 |
| 新株予約権の譲渡に関する事項 | 同上 |
| 代用払込みに関する事項 | 同上 |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | 同上 |
(第11回新株予約権)
| 決議年月日 | 平成22年1月26日 臨時株主総会決議(平成22年3月29日 取締役会決議) |
|---|---|
| 付与対象者の区分及び人数(名) | 当社取締役1名 |
| 新株予約権の目的となる株式の種類 | 「(2)新株予約権等の状況」に記載しております。 |
| 株式の数 | 同上 |
| 新株予約権の行使時の払込金額 | 同上 |
| 新株予約権の行使期間 | 同上 |
| 新株予約権の行使の条件 | 同上 |
| 新株予約権の譲渡に関する事項 | 同上 |
| 代用払込みに関する事項 | 同上 |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | 同上 |
(第13回新株予約権)
| 決議年月日 | 平成22年1月26日 臨時株主総会決議(平成22年7月16日 取締役会決議) |
|---|---|
| 付与対象者の区分及び人数(名) | 当社従業員4名 |
| 新株予約権の目的となる株式の種類 | 「(2)新株予約権等の状況」に記載しております。 |
| 株式の数 | 同上 |
| 新株予約権の行使時の払込金額 | 同上 |
| 新株予約権の行使期間 | 同上 |
| 新株予約権の行使の条件 | 同上 |
| 新株予約権の譲渡に関する事項 | 同上 |
| 代用払込みに関する事項 | 同上 |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | 同上 |
(第14回新株予約権)
| 決議年月日 | 平成22年1月26日 臨時株主総会決議(平成22年8月13日 取締役会決議) |
|---|---|
| 付与対象者の区分及び人数 | 当社従業員9名 |
| 新株予約権の目的となる株式の種類 | 「(2)新株予約権等の状況」に記載しております。 |
| 株式の数 | 同上 |
| 新株予約権の行使時の払込金額 | 同上 |
| 新株予約権の行使期間 | 同上 |
| 新株予約権の行使条件 | 同上 |
| 新株予約権の譲渡に関する事項 | 同上 |
| 代用払込みに関する事項 | 同上 |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | 同上 |
(第15回新株予約権)
| 決議年月日 | 平成22年1月26日 臨時株主総会決議(平成22年8月31日 取締役会決議) |
|---|---|
| 付与対象者の区分及び人数 | 当社取締役2名 |
| 新株予約権の目的となる株式の種類 | 「(2)新株予約権等の状況」に記載しております。 |
| 株式の数 | 同上 |
| 新株予約権の行使時の払込金額 | 同上 |
| 新株予約権の行使期間 | 同上 |
| 新株予約権の行使条件 | 同上 |
| 新株予約権の譲渡に関する事項 | 同上 |
| 代用払込みに関する事項 | 同上 |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | 同上 |
2 【自己株式の取得等の状況】
Section titled “2 【自己株式の取得等の状況】”【株式の種類等】 会社法第155条第7号による普通株式の取得
(1)【株主総会決議による取得の状況】
Section titled “(1)【株主総会決議による取得の状況】”該当事項はありません。
(2)【取締役会決議による取得の状況】
Section titled “(2)【取締役会決議による取得の状況】”該当事項はありません。
(3)【株主総会決議又は取締役会決議に基づかないものの内容】
Section titled “(3)【株主総会決議又は取締役会決議に基づかないものの内容】”| 区分 | 株式数(株) | 価額の総額(千円) |
|---|---|---|
| 当事業年度における取得自己株式 | 50 | 197 |
| 当期間における取得自己株式 | ― | ― |
(4)【取得自己株式の処理状況及び保有状況】
Section titled “(4)【取得自己株式の処理状況及び保有状況】”| 区分 | 当事業年度 | 当期間 | ||
| 株式数(株) | 処分価額の総額(千円) | 株式数(株) | 処分価額の総額(千円) | |
| 引き受ける者の募集を行った取得自己株式 | ― | ― | ― | ― |
| 消却の処分を行った取得自己株式 | ― | ― | ― | ― |
| 合併、株式交換、会社分割に係る移転を行った取得自己株式 | ― | ― | ― | ― |
| その他( ― ) | ― | ― | ― | ― |
| 保有自己株式数 | 50 | ― | 50 | ― |
3 【配当政策】
Section titled “3 【配当政策】”当社は創業以来配当を実施しておりません。
当社は医薬品の開発を行っており、企業価値を確固たるものにするために、既存開発パイプラインの進展及び新規パイプラインの充実化を図ることが重要なことから、積極的に研究開発資金を投入してまいります。したがって、当面は利益配当を実施せず、内部留保を行い、研究開発活動の充実化に備えた資金確保を優先いたします。しかしながら、株主への利益還元についても重要な経営課題と認識しており、当社の経営成績及び財政状態、事業計画等を総合的に勘案した上で、利益配当を検討していく所存であります。
なお、剰余金の配当を行う場合は、年1回期末での配当を考えておりますが、当社は、剰余金の配当につき、会社法第454条第5項に基づく中間配当を行うことができる旨を定款で定めております。これらの剰余金の配当の決定機関は、期末配当については株主総会、中間配当については取締役会であります。
4 【株価の推移】
Section titled “4 【株価の推移】”(1)【最近5年間の事業年度別最高・最低株価】
Section titled “(1)【最近5年間の事業年度別最高・最低株価】”| 回次 | 第6期 | 第7期 | 第8期 | 第9期 | 第10期 |
|---|---|---|---|---|---|
| 決算年月 | 平成21年12月 | 平成22年12月 | 平成23年12月 | 平成24年12月 | 平成25年12月 |
| 最高(円) | ― | ― | ― | 1,730 | 9,830 |
| 最低(円) | ― | ― | ― | 1,173 | 1,690 |
(注) 1.最高・最低株価は、東京証券取引所マザーズにおける株価を記載しております。
2.当社株式は、平成24年12月11日から東京証券取引所マザーズに上場しております。それ以前については、該当事項はありません。
(2)【最近6月間の月別最高・最低株価】
Section titled “(2)【最近6月間の月別最高・最低株価】”| 月別 | 平成25年7月 | 8月 | 9月 | 10月 | 11月 | 12月 |
|---|---|---|---|---|---|---|
| 最高(円) | 4,400 | 3,545 | 4,750 | 4,210 | 4,160 | 4,330 |
| 最低(円) | 3,240 | 2,251 | 2,120 | 3,160 | 3,390 | 3,050 |
(注) 最高・最低株価は、東京証券取引所マザーズにおける株価を記載しております。
5 【役員の状況】
Section titled “5 【役員の状況】”| 役名 | 職名 | 氏名 | 生年月日 | 略歴 | 任期 | 所有株式数(株) | |
| 代表取締役会長兼社長 | ― | 平野 達義 | 昭和34年4月6日 | 昭和59年4月 | 信越化学工業株式会社入社 | (注)3 | ― |
| 平成7年12月 | 日本トイザらス株式会社入社 | ||||||
| 平成15年4月 | 同社 執行役員経営企画室長兼財務部長 | ||||||
| 平成16年4月 | 同社 取締役兼最高財務責任者 財務本部長兼経営企画室長 | ||||||
| 平成18年4月 | 同社 代表取締役副社長兼最高財務責任者 | ||||||
| 平成21年1月 | 当社入社 財務部長 | ||||||
| 平成21年4月 | 当社 取締役CFO | ||||||
| 平成22年5月 | 株式会社UNIGEN 代表取締役社長 | ||||||
| 平成23年3月 | 同社 取締役 | ||||||
| 平成24年3月平成25年3月 平成25年8月 | 当社 代表取締役社長当社 取締役(現任)株式会社UNIGEN 代表取締役社長(現任)当社 代表取締役会長兼社長(現任) | ||||||
| 取締役 | 臨床開発部長 | 中田 文久 | 昭和43年2月18日 | 平成4年4月 | 日清製粉株式会社(現株式会社日清製粉グループ本社)入社 | (注)3 | ― |
| 平成19年2月 | グラクソ・スミスクライン株式会社 入社 | ||||||
| 平成22年3月 | 当社入社 臨床開発部薬事担当部長 | ||||||
| 平成22年4月 | 当社 薬事部長 | ||||||
| 平成22年8月 | 当社 取締役(現任) | ||||||
| 平成23年8月 | 当社 臨床開発部長(現任) | ||||||
| 取締役 | 財務部長 | 橋本 裕之 | 昭和43年7月2日 | 平成3年4月 | 藤沢薬品工業株式会社(現アステラス製薬株式会社)入社 | (注)3 | 13,000 |
| 平成13年5月 | 株式会社BCJコンサルティング 入社 | ||||||
| 平成14年3月 | 先端科学技術エンタープライズ株式会社 取締役 | ||||||
| 平成18年8月 | 当社入社 経営企画部マネージャー | ||||||
| 平成24年1月 | 当社 財務部長(現任) | ||||||
| 平成24年3月平成24年12月 | 当社 取締役(現任) 株式会社UNIGEN 取締役 | ||||||
| 取締役 | ― | 成清 勉 | 昭和35年3月9日 | 昭和57年4月 | 石川島播磨重工業株式会社(現株式会社IHI)入社 | (注)3 | ― |
| 平成16年7月 | 同社 技術開発本部管理部技術企画グループ部長 | ||||||
| 平成20年10月 | 同社 経営企画部新事業企画グループ部長 | ||||||
| 平成22年4月 | 同社 新事業推進部企画管理グループ部長 | ||||||
| 平成22年6月 | 株式会社UNIGEN 取締役(現任) | ||||||
| 平成24年3月 | 当社 取締役(現任) | ||||||
| 平成24年4月 | 株式会社IHI 新事業推進部バイオプロジェクトグループ部長(現任) | ||||||
| 役名 | 職名 | 氏名 | 生年月日 | 略歴 | 任期 | 所有株式数(株) | |
| 監査役(常勤) | ― | 高木 淳一 | 昭和30年11月15日 | 昭和54年4月 | 松下電器貿易株式会社(現パナソニック株式会社)入社 | (注)4 | ― |
| 平成9年10月 | 株式会社CSK(現SCSK株式会社)入社 理事 | ||||||
| 平成19年8月 | 当社 取締役財務部長 | ||||||
| 平成21年4月 | 当社 常勤監査役(現任) | ||||||
| 平成22年5月 | 株式会社UNIGEN 監査役(現任) | ||||||
| 監査役 | ― | 加藤 久満 | 昭和19年6月13日 | 昭和44年9月 | 東芝情報システム株式会社入社 | (注)4 | ― |
| 平成元年9月 | 同社 医用情報システム部部長 | ||||||
| 平成4年4月 | 同社 オープンシステム営業部部長 | ||||||
| 平成8年4月 | 同社 製造システム営業部部長 | ||||||
| 平成15年4月 | インターネットタウン株式会社入社 | ||||||
| 平成16年9月 | 神奈川県県士整備経理課入庁 | ||||||
| 平成18年3月 | 当社 監査役(現任) | ||||||
| 監査役 | ― | 加藤 凱信 | 昭和11年12月7日 | 昭和30年4月 | 野村證券株式会社入社 | (注)4 | ― |
| 昭和34年12月 | 東洋信託銀行株式会社(現三菱UFJ信託銀行株式会社)入社 | ||||||
| 平成12年2月 | ビー・エヌ・ピー信託銀行株式会社(後にビー・エヌ・ピー・パリバ信託銀行株式会社 現株式会社新銀行東京)入社ファーストバイスプレジデント | ||||||
| 平成17年6月 | NPO法人C.P.I.教育文化交流推進委員会理事(現任) | ||||||
| 平成18年7月 | 当社 監査役(現任) | ||||||
| 計 | 13,000 | ||||||
(注) 1.取締役成清勉は、社外取締役であります。
2.監査役加藤久満及び監査役加藤凱信は、社外監査役であります。
3.取締役の任期は、平成25年12月期に係る定時株主総会終結の時から平成27年12月期に係る定時株主総会の終
結の時までであります。
4.監査役の任期は、平成24年10月23日開催の臨時株主総会終結の時から平成27年12月期に係る定時株主総会の
終結の時までであります。
6 【コーポレート・ガバナンスの状況等】
Section titled “6 【コーポレート・ガバナンスの状況等】”(1)【コーポレート・ガバナンスの状況】
Section titled “(1)【コーポレート・ガバナンスの状況】”① 企業統治の体制
a. 基本的な考え方
当社は、最先端のバイオ技術を駆使して次世代のバイオ医薬品を広く社会へ提供することが使命であります。この使命を着実に果たすことが、永続的な社業の生成発展、及び企業価値の向上につながり、ひいては広く社会や株主の皆様への責任を果たせるものと考えております。かかる使命を果たすためには、「企業経営の適法性」及び「企業経営の効率性の確保」を担保するコーポレート・ガバナンスの体制構築が必須であり、経営上の重要課題と認識しております。
また、株主や投資家の皆様に対しては、公正かつタイムリーな情報開示を進めるとともに、決算説明会等における積極的なIR活動を通じて、一層の経営の透明性向上に努めてまいります。
b. 企業統治の体制の概要
当社グループの企業統治体制の概要図は以下のとおりであります。
当社は、監査役会設置会社として、株主総会、取締役会、監査役会及び会計監査人を決定機関として設置するほか、経営会議、内部監査室を設置して、経営の適法性、効率性を担保する体制を構築しております。
(a) 取締役会
当社の取締役会は4名(うち社外取締役1名)により構成し、当社の業務執行を決定し、取締役の職務の執行を監督する権限を有しております。新規事業育成・推進に造詣と実績を有する人材を社外取締役に起用することにより、多角的な視点を取り入れ、事業の拡大発展、着実な企業価値向上に向けて最適な意思決定を行うことのできる仕組みを構築しております。「取締役会規程」に基づき、定例の取締役会を毎月1回開催するほか、必要に応じて適宜臨時に開催しております。取締役会では、「経営の適法性」及び「経営の効率性」の観点から当社グループの業務執行に関する意思決定を行い、取締役の職務執行を監督しております。
(b) 監査役会
当社の監査役会は3名(常勤監査役1名、社外監査役2名)で構成されております。「監査役会規程」に基づき、毎月1回定例の監査役会を開催するほか、必要に応じて臨時の監査役会を開催し、取締役の法令、定款及び規程等の遵守状況を把握し、「監査役監査規程」に則り監査計画に基づいて業務監査及び会計監査が有効に実施されるように努めております。各監査役は取締役会へ出席するとともに、監査役会等にて各取締役及び幹部社員、内部監査室、信頼性保証部等から直接報告を受けております。また、各監査役はその担当分野を中心に実施した日常の監査結果を監査役会へ持ち寄り、情報共有を行っております。加えて、会計監査人とも連携して、適正な監査の実施に努めております。
当社は、取締役会の合議制による意思決定と監査役会設置によるコーポレート・ガバナンスが経営機能を有効に発揮できるシステムと判断し、上記体制を採用しております。
(c) 経営会議
経営戦略及び経営の重要な案件についてより深く討議を行うため、「経営会議規程」に基づき、代表取締役社長及び常任取締役により構成される経営会議を設置し、必要に応じて関係する者を交えて、原則月1回開催しております。経営会議は、取締役会で決定した基本方針に基づき、グループ全社ならびに各部門の経営課題等を審議するとともに、業務執行に係る協議及び報告が適宜行われ、業務執行状況のチェック機能を果たしております。さらに、経営会議においては、取締役会上程前の議案について審議が行われることで、経営課題の最終決定に至る過程の透明性及び精度が高まるとともに、効率的な会社運営が図られております。なお、経営会議で行われた業務遂行に係る協議及び報告の内容は、取締役会にて報告されております。また常勤監査役は、オブザーバーとして経営会議に出席しております。
c. 当該企業統治の体制を採用する理由
当社取締役会は、事業の専門性に鑑み、健全かつ効率的な事業運営を行うため社内取締役を中心に構成されております。一方で、新規事業育成・推進に造詣と実績を有する人材を社外取締役に起用し、社外監査役を含む監査役会の経営監視機能により、経営の意思決定に係る客観性及び透明性の確保が実現できるものと考え、上記企業統治体制を採用しております。
d. 内部統制システムの整備の状況
当社は、会社法第362条第5項及び会社法施行規則第100条の規定に則り、平成18年5月19日開催の取締役会において当社の業務の適性を確保するための体制(内部統制システムの構築に関する基本方針)について決議し、平成19年3月16日、平成22年12月17日、平成23年2月10日開催の取締役会において見直しを実施いたしました。かかる基本方針に基づき、以下のとおり内部統制システムの体制に関して定め、運用しております。
(a) 取締役及び使用人の職務の執行が法令及び定款に適合することを確保するための体制
当社の役員及び従業員は、当社が上場会社であることならびに人の生命・身体に係る医薬品事業の当事者であることを強く意識し、会社法、金融商品取引法、金融商品取引所規則、薬事法及び関連規則、その他の法令の遵守を徹底するため、「コンプライアンス規程」等の諸規程を制定し、重要な会議等の場で継続的に周知徹底を図っております。
監査役、内部監査室、信頼性保証部及び会計監査人は、当社の役員及び従業員の職務の執行が関係法令及び規則、定款・規程等を遵守して行われているかを監視し、相互の連携を図るとともに、適宜、社長及び取締役会へ報告するなど、業務の適性を確保する体制を整備、運用しております。
「内部通報規程」に基づき内部通報システムを構築し、法令・定款等違反行為を未然に防止する体制を整えております。
株主・投資家に対しては、「ディスクロージャー規程」に基づき適時開示体制を整備、構築することにより、経営の透明性の向上を図ることに努めております。
社会の秩序や安全に脅威を与える反社会的勢力に対しては、毅然とした態度で一切の関係を遮断すべく、「反社会的勢力排除規程」を制定し、そのための体制整備を行い、運用を徹底しております。
(b) 取締役の職務の執行に係る情報の保存および管理に関する体制
取締役会その他重要な会議の意思決定に係る議事録や、「職務権限規程」に基づいて決裁された文書等、取締役の職務に係る文書(電磁的記録を含む。以下同じ。)は、関連資料を含めて「文書管理規程」に定められた方法、期間に準じて適切に保存及び管理をしております。
内部監査室、信頼性保証部及び監査役が定期的に重要な文書の管理、保管状況を監査するとともに、必要に応じて閲覧、謄写が可能な状態を維持しております。
(c) 損失の危機の管理に関する規程その他の体制
経営上のリスクに関しては、経営課題とともにリスクを洗い出し、常にリスクを最小限にすることを意識しつつ、業務執行及び意思決定を行っております。
リスクコントロール体制の基礎として「リスク管理規程」を定め、総務部管掌役員をリスク管理統括責任者としてリスク管理体制を構築し、リスクの開示及びクライシス発生時の対応に関する手順を明確化し、役員及び従業員へ周知徹底をいたしております。また、内部監査室が内部監査を実施することで、運用体制を強化いたしております。
当社の重要な資産である情報に関しては、「情報セキュリティ管理規程」を制定し、情報ネットワークシステムのセキュリティ体制を強化するとともに、役員及び従業員に対して情報セキュリティポリシー等のルールの周知を行い、厳格な情報管理体制を構築しております。
新型インフルエンザのパンデミック、大地震などの突発的緊急事態に対しては、社長をリスク管理統括責任者とする緊急事態対応体制をとり、緊急事態に迅速に対応いたします。
(d) 取締役の職務の執行が効率的に行われることを確保するための体制
当社グループの事業の社会的使命、経営目標、事業戦略が常に明確にされ、それを基に「中期経営計画」、「年度事業計画」ならびに「年度予算」が策定され、役員及び従業員で共有いたしております。
職務の執行にあたっては、最低月1回開催される経営会議等において役員、幹部社員で情報共有が行われ、議論を尽くしたうえで取締役会へ上程されるなど、取締役の職務の執行が効率的に行われる体制を構築しております。
取締役会決議に基づく業務執行については、「業務分掌規程」、「職務権限規程」、「稟議規程」等において、執行の手続きが明確かつ簡明に定められ、効率的な業務執行を可能にしております。
(e) 当社ならびにその親会社及び子会社から成る企業集団における業務の適正を確保するための体制
当社の子会社に関しては、「関係会社管理規程」に基づき、事業開発部が子会社の重要な意思決定、事業進捗状況等の管理を行い、グループ全体の経営効率の向上、最適化を図っております。
グループ全体の内部統制の実効性を高めるため、内部監査室が定期的に子会社の内部監査を実施し、内部統制システムの整備、運用状況を監査し、社長、監査役会へ報告いたしております。
子会社の監査役が親会社の監査役会で定期的に監査結果を報告し、情報共有を図っております。
(f) 監査役がその職務を補助すべき使用人を置くことを求めた場合における当該使用人に関する事項
現在は、監査役の職務を補助するスタッフはおりませんが、監査役会がその職務を補助する従業員を置くことを求めた場合には、当社従業員を配置いたします。
(g) 前号の使用人の取締役からの独立性に関する事項
前号の監査役付の従業員を置いた場合は、その独立性を確保するため、当該使用人の任命、異動等の人事に関する事項の決定には、監査役の同意を必要といたします。なお、当該従業員は、業務の執行に係る役職を兼務いたしません。
(h) 取締役及び使用人が監査役に報告をするための体制その他の監査役への報告に関する体制
監査役への報告事項は、以下のとおりといたします。
イ 内部統制システムの整備状況及びその運用状況
ロ 業績及び業績見込みの内容、重要開示書類の内容
ハ 会社に著しい損害が発生するおそれがある事実を発見した場合、その事実
ニ その他監査役が報告を求める事項
取締役及び従業員は、監査役会の定めるところに従い、各監査役の要請に応じて必要な報告及び情報共有を行っております。
(i) その他監査役の監査が実効的に行われることを確保するための体制
監査役会は、定期的に社長及び各担当役員より報告を受け、情報交換を行っております。
監査役は、内部監査室、信頼性保証部の年次監査計画及び監査の実施状況に関して適宜報告を受け、指摘、提言事項について意見交換する等、密接な情報交換及び連携を図っております。
監査役及び内部監査室は、会計監査人の監査計画及び監査結果の報告を受ける等、相互の連携かつ牽制を図っております。
監査役は、監査の実施にあたり必要と認めるときは、弁護士、公認会計士、コンサルタントその他の外部アドバイザーを任用することができます。
e. リスク管理体制の整備の状況
Section titled “e. リスク管理体制の整備の状況”当社は、医薬品の研究・開発・製造・販売を主な事業とする企業として、さまざまな潜在的なリスクが存在しております。これらのリスクを適切に管理するために、上述の内部統制システムのもとに「リスク管理規程」を定めて、リスク管理を遂行する体制を整え、リスク発生時の迅速な情報収集及び指揮命令体制を確立することにより、リスク対応力の強化を図っております。
事業活動全般にわたり発生する可能性のあるさまざまなリスクのうち、経営上の重大なリスクに関しては、関連部署と事業開発部においてリスク分析及びその対応策等の検討を行い、また必要に応じて外部の専門家に照会を行ったうえで、経営会議及び取締役会において当該リスクに関する情報の共有化ならびにリスク回避の方策に関する審議・決定を行っております。
リスク管理に関連して、コンプライアンスに関する事項については、重要な契約、法的判断に関して、法律事務所と顧問契約を締結し、適宜相談して助言・指導を受ける体制を整えております。また従業員には、それぞれの立場でコンプライアンスを自らの問題として捉え業務運営に当たるよう、日常の会議等で指導しております。
また、定期的に実施される内部監査室による内部監査を通じて、さまざまなリスクを未然に防止するよう努めるとともに、リスク管理体制の有効性を検証しております。
さらに、企業運営において重要な経営リソースである情報システムに関しては、総務部が中心となり、当該システムに係るリスク回避策として、システム障害時の早期復旧のためのセキュリティ対策、コンピューターウイルスの侵入やハッカーの妨害を回避するために必要と考えられる対策を講じております。
② 内部監査及び監査役監査
当社の内部監査は、代表取締役社長直轄の内部監査室を設置し、内部監査を実施しております。内部監査室長は内部監査計画書を作成し、代表取締役社長の承認を得た後、被監査部門に対して通知を行い、会社の業務及び財産の状況を監査し、業務の適法性及び効率性に資することを目的に内部監査を実施しております。各部門の業務活動が法令、定款、諸規程に準拠して執行されているかを検証し、内部監査の終了時にはその結果を代表取締役社長に報告しております。代表取締役社長は、監査報告書に基づき対処処置を必要とする事項については被監査部門へ改善指示書により指示命令をするとともに、その改善状況について報告を受け、確認をしております。また、監査役に対しても内部監査の計画及び結果等に関して適宜報告し、意見交換を行うなど連携を深めております。
当社の監査役会は、監査役3名(常勤監査役1名、社外監査役2名)が「監査役会規程」に基づき、毎月1回、定例の監査役会を開催するほか、必要に応じて臨時の監査役会を開催し、取締役の法令、定款及び規程等の遵守状況を把握し、「監査役監査規程」に則り監査計画に基づいて、業務監査及び会計監査が有効に実施されるように努めております。各監査役は取締役会へ出席するとともに、監査役会等にて各取締役及び幹部社員、信頼性保証部等から直接報告を受けております。また、各監査役はその担当分野を中心に実施した日常の監査結果を監査役会へ持ち寄り、情報共有を行っております。
当社では、内部監査室長が内部監査の計画及び結果等に関して監査役会で定期的に報告し意見交換をするなど、内部監査室と監査役会との連携を構築しております。
また、内部監査室は会計監査人と定期的に意見交換を行い、課題・改善事項についても共有を図り、内部監査室と会計監査人との間の連携を強化しております。
監査役会は、会計監査人より期末の監査結果の報告を受け、意見交換を行う他に、期中監査及び四半期レビューの結果に関しても報告を受け、意見交換を行うなど、監査役会と会計監査人との連携も強化しております。
③ 社外取締役及び社外監査役
取締役成清勉氏は会社法第2条第15号に定める社外取締役であり、監査役加藤久満氏と加藤凱信氏は会社法第2条第16号に定める社外監査役であります。
取締役成清勉氏は、当社の主要大株主であり事業協力会社である株式会社IHIの幹部社員であり、同社にて新規事業育成・推進に造詣と実績を有しております。
社外取締役は、取締役会での議案審議等において、適宜必要な発言をすることにより、取締役会における監視・牽制の機能を果たすほか、外部の幅広い知見に基づく助言・提言により取締役会が適切かつ柔軟な経営判断を下すための機能を果たしております。
監査役加藤久満氏は、東芝情報システム株式会社での勤務、ベンチャー企業経営の経験を通じ、また、監査役加藤凱信氏は、東洋信託銀行株式会社(現、三菱UFJ信託銀行株式会社)における勤務経験等を通じ、企業の内部統制システムの構築、運用に経験と知見を有しております。
社外監査役は、保有する専門的見地に基づき、取締役会の意思決定の妥当性・適正性を確保するための助言・提言を行う機能を有しております。
社外取締役及び社外監査役の独立性に関する基準または方針はありませんが、社外監査役加藤久満氏及び加藤凱信氏の2名を、一般株主との利益相反が生じるおそれのない独立役員として株式会社東京証券取引所に届け出ており、客観的に独立性の高い社外取締役及び社外監査役の確保に努めております。
当社の社外取締役は、取締役会において監査役会から監査役監査並びに会計監査人監査の結果につき報告を受け連携し、社外監査役は、会計監査人及び内部監査室から適宜必要な報告を受け、意見交換を行うとともに取締役会では議案等に対し適宜質問や監査上の所感を述べ、実質的な意見交換を行っており、情報の収集及び課題の共有を図っております。
④ 役員の報酬等
a. 提出会社の役員区分ごとの報酬等の総額、報酬等の種類別の総額及び対象となる役員の員数
Section titled “a. 提出会社の役員区分ごとの報酬等の総額、報酬等の種類別の総額及び対象となる役員の員数”| 役員区分 | 報酬等の総額(千円) | 報酬等の種類別総額(千円) | 対象となる役員の人数(人) | ||
| 基本報酬 | 賞与 | ストック・オプション | |||
| 取締役 (注1)(社外取締役を除く) | 52,400 | 52,400 | ― | ― | 5 |
| 監査役(社外監査役を除く) | 8,640 | 8,640 | ― | ― | 1 |
| 社外役員 | 3,240 | 3,240 | ― | ― | 3 |
(注) 1.平成25年8月に辞任した取締役1名及び平成25年12月に辞任した取締役1名を含んでおります。
2.取締役の報酬限度額は、平成22年8月31日開催の臨時株主総会において、使用人兼務取締役の使用人給与を除く役員報酬を年額144,000千円以下と決議いただいております。
3.監査役の報酬限度額は、平成18年3月29日開催の第2回定時株主総会において月額1,000千円以下と決議いただいております。
4.期末日現在の取締役は4名、監査役は3名であります。
b. 提出会社の役員ごとの連結報酬等の総額等
連結報酬等の総額が1億円以上である者が存在しないため、記載しておりません。
c. 使用人兼務役員の使用人給与のうち、重要なもの
該当事項はありません。
d. 役員の報酬等の額またはその算定方法の決定に関する方針
(a) 取締役の報酬について
取締役の報酬額は、株主総会で承認された報酬総額の範囲内で、業績、個人の貢献度等を総合的に勘案し、取締役会にて決定しております。
(b) 監査役の報酬について
監査役の報酬額は、株主総会で承認された報酬総額の範囲内で、監査役の協議により決定しております。
⑤ 株式の保有状況
a. 保有目的が純投資以外の目的である投資株式
該当事項はありません。
b. 保有目的が純投資目的以外の目的である投資株式の保有区分、銘柄、株式数、貸借対照表計上額及び保有目的
該当事項はありません。
c. 保有目的が純投資目的である投資株式
該当事項はありません。
⑥ 会計監査の状況
当社の会計監査業務を執行した公認会計士は、有限責任監査法人トーマツに所属し、その氏名及び監査業務に係る補助者の構成については下記のとおりであります。
(業務を執行した公認会計士の氏名)
業務執行社員 片岡久依
業務執行社員 勢志 元
(会計監査業務に係る補助者の構成)
公認会計士4名 その他4名
⑦ 社外取締役及び社外監査役の責任限定契約
当社と社外取締役及び社外監査役は、会社法第427条第1項に基づき、会社法第423条第1項に定める損害賠償責任について、任務を怠ったことによる損害賠償責任を限定する契約を締結できる旨、当社定款第30条(社外取締役)及び第40条(社外監査役)に定めております。また、当該契約に基づく賠償責任の限度額を200万円以上で予め定めた金額または法令が規定する金額のいずれか高い額としております。
ただし、現状当社の社外取締役及び社外監査役との間でかかる契約の締結は行っておりません。
⑧ 取締役会で決議できる株主総会決議事項
a. 自己の株式の取得
当社は、機動的な資本政策の遂行を可能とするため、会社法第165条第2項の規定により、取締役会の決議によって市場取引等により自己の株式を取得することができる旨を定款に定めております。
b. 中間配当
当社は、株主への機動的な利益還元を可能とするため、会社法第454条第5項の規定により取締役会の決議によって毎年6月30日を基準日として中間配当を行うことができる旨定款に定めております。
⑨ 取締役の定数
当社の取締役は7名以内とする旨、定款に定めております。
⑩ 取締役の選任の決議要件
当社は、取締役の選任決議について、議決権を行使することのできる株主の議決権の3分の1以上を有する株主が出席し、その議決権の過半数をもって行い、累積投票によらない旨を定款に定めております。
⑪ 株主総会の特別決議要件
当社は、株主総会の円滑な運営を行うことを目的として、会社法第309条第2項に定める株主総会の特別決議要件について、議決権を行使することのできる株主の議決権の3分の1以上を有する株主が出席し、その議決権の3分の2以上をもって行う旨を定款に定めております。
(2)【監査報酬の内容等】
Section titled “(2)【監査報酬の内容等】”① 【監査公認会計士等に対する報酬の内容】
Section titled “① 【監査公認会計士等に対する報酬の内容】”| 区分 | 前連結会計年度 | 当連結会計年度 | ||
| 監査証明業務に基づく報酬(千円) | 非監査業務に基づく報酬(千円) | 監査証明業務に基づく報酬(千円) | 非監査業務に基づく報酬(千円) | |
| 提出会社 | 14,000 | 1,600 | 14,500 | 350 |
| 連結子会社 | 2,000 | ― | 4,500 | ― |
| 計 | 16,000 | 1,600 | 19,000 | 350 |
② 【その他重要な報酬の内容】
Section titled “② 【その他重要な報酬の内容】”該当事項はありません。
③ 【監査公認会計士等の提出会社に対する非監査業務の内容】
Section titled “③ 【監査公認会計士等の提出会社に対する非監査業務の内容】”(前連結会計年度)
当社が監査公認会計士等に対して報酬を支払っている非監査業務の内容は、株式公開に向けた各種アドバイザリー・サービス及び「監査人から引受幹事会社への書簡」作成業務等であります。
(当連結会計年度)
当社が監査公認会計士等に対して報酬を支払っている非監査業務の内容は、財務報告に係る内部統制に関する助言、指導業務等であります。
④ 【監査報酬の決定方針】
Section titled “④ 【監査報酬の決定方針】”該当事項はありませんが、監査人員数、監査日程等を勘案の上、決定しております。
第5 【経理の状況】
Section titled “第5 【経理の状況】”1. 連結財務諸表及び財務諸表の作成方法について
(1) 当社の連結財務諸表は、「連結財務諸表の用語、様式及び作成方法に関する規則」(昭和51年大蔵省令第28号。以下、「連結財務諸表規則」という。)に基づいて作成しております。
(2) 当社の財務諸表は、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づいて作成しております。
2. 監査証明について
当社は、金融商品取引法第193条の2第1項の規定に基づき、連結会計年度(平成25年1月1日から平成25年12月31日まで)の連結財務諸表及び事業年度(平成25年1月1日から平成25年12月31日まで)の財務諸表について、有限責任監査法人トーマツの監査を受けております。
3. 連結財務諸表等の適正性を確保するための特段の取り組みについて
当社は、会計基準等の内容把握や変更等について適切に対応するため、公益財団法人財務会計基準機構に加入し情報収集を図り、同機構が行う研修等に参加しております。
1 【連結財務諸表等】
Section titled “1 【連結財務諸表等】”(1)【連結財務諸表】
Section titled “(1)【連結財務諸表】”① 【連結貸借対照表】
Section titled “① 【連結貸借対照表】”| (単位:千円) | |||||||||||
| 前連結会計年度(平成24年12月31日) | 当連結会計年度(平成25年12月31日) | ||||||||||
| 資産の部 | |||||||||||
| 流動資産 | |||||||||||
| 現金及び預金 | ※1 3,882,943 | ※1 4,267,657 | |||||||||
| 売掛金 | 108,225 | - | |||||||||
| 仕掛品 | - | 514 | |||||||||
| 原材料及び貯蔵品 | 33,979 | 106,081 | |||||||||
| 前渡金 | 32,516 | 72,871 | |||||||||
| 未収消費税等 | 91,948 | 789,050 | |||||||||
| その他 | 40,647 | 160,208 | |||||||||
| 流動資産合計 | 4,190,259 | 5,396,385 | |||||||||
| 固定資産 | |||||||||||
| 有形固定資産 | |||||||||||
| 建物及び構築物 | ※1、2 465,487 | ※1、2 6,392,443 | |||||||||
| 減価償却累計額 | △40,582 | △337,845 | |||||||||
| 建物及び構築物(純額) | 424,904 | 6,054,598 | |||||||||
| 機械及び装置 | ※2 123,093 | ※2 6,881,720 | |||||||||
| 減価償却累計額 | △41,189 | △913,196 | |||||||||
| 機械及び装置(純額) | 81,904 | 5,968,524 | |||||||||
| 工具、器具及び備品 | ※2 232,179 | ※2 353,086 | |||||||||
| 減価償却累計額 | △113,744 | △180,407 | |||||||||
| 工具、器具及び備品(純額) | 118,434 | 172,679 | |||||||||
| リース資産 | 191,323 | 734,625 | |||||||||
| 減価償却累計額 | △2,661 | △104,693 | |||||||||
| リース資産(純額) | 188,661 | 629,932 | |||||||||
| 建設仮勘定 | 8,781,150 | 1,050 | |||||||||
| 有形固定資産合計 | 9,595,055 | 12,826,784 | |||||||||
| 無形固定資産 | |||||||||||
| ソフトウエア | ※2 39,342 | ※2 410,984 | |||||||||
| その他 | 635 | 395 | |||||||||
| 無形固定資産合計 | 39,977 | 411,379 | |||||||||
| 投資その他の資産 | |||||||||||
| 投資有価証券 | 144,086 | - | |||||||||
| 長期前払費用 | 1,447 | 360 | |||||||||
| 敷金及び保証金 | 60,817 | 66,884 | |||||||||
| 長期未収入金 | - | 300,000 | |||||||||
| 投資その他の資産合計 | 206,350 | 367,244 | |||||||||
| 固定資産合計 | 9,841,384 | 13,605,408 | |||||||||
| 資産合計 | 14,031,644 | 19,001,793 | |||||||||
| (単位:千円) | |||||||||||
| 前連結会計年度(平成24年12月31日) | 当連結会計年度(平成25年12月31日) | ||||||||||
| 負債の部 | |||||||||||
| 流動負債 | |||||||||||
| 短期借入金 | - | 1,484,300 | |||||||||
| 1年内返済予定の長期借入金 | 1,100,000 | ※1 2,710,000 | |||||||||
| リース債務 | 25,354 | 94,071 | |||||||||
| 未払金 | 136,252 | 382,348 | |||||||||
| 未払法人税等 | 22,629 | 29,631 | |||||||||
| 前受金 | - | 11,200 | |||||||||
| 預り金 | 11,013 | 8,537 | |||||||||
| 資産除去債務 | 6,565 | - | |||||||||
| その他 | 14,385 | 7,983 | |||||||||
| 流動負債合計 | 1,316,200 | 4,728,073 | |||||||||
| 固定負債 | |||||||||||
| 長期借入金 | ※1 7,810,000 | ※1 8,875,000 | |||||||||
| リース債務 | 165,192 | 549,093 | |||||||||
| 長期預り金 | ※3 340,332 | ※3 340,332 | |||||||||
| 繰延税金負債 | 7,350 | 56,334 | |||||||||
| 資産除去債務 | 13,591 | 168,099 | |||||||||
| その他 | 9,684 | 31,368 | |||||||||
| 固定負債合計 | 8,346,150 | 10,020,229 | |||||||||
| 負債合計 | 9,662,350 | 14,748,302 | |||||||||
| 純資産の部 | |||||||||||
| 株主資本 | |||||||||||
| 資本金 | 5,152,348 | 6,956,361 | |||||||||
| 資本剰余金 | 4,821,348 | 6,625,361 | |||||||||
| 利益剰余金 | △5,662,131 | △9,379,249 | |||||||||
| 自己株式 | - | △197 | |||||||||
| 株主資本合計 | 4,311,564 | 4,202,277 | |||||||||
| その他の包括利益累計額 | |||||||||||
| その他有価証券評価差額金 | 5,075 | - | |||||||||
| その他の包括利益累計額合計 | 5,075 | - | |||||||||
| 新株予約権 | - | 6,251 | |||||||||
| 少数株主持分 | 52,652 | 44,962 | |||||||||
| 純資産合計 | 4,369,293 | 4,253,491 | |||||||||
| 負債純資産合計 | 14,031,644 | 19,001,793 | |||||||||
② 【連結損益計算書及び連結包括利益計算書】
Section titled “② 【連結損益計算書及び連結包括利益計算書】”【連結損益計算書】
Section titled “【連結損益計算書】”| (単位:千円) | |||||||||||
| 前連結会計年度(自 平成24年1月1日 至 平成24年12月31日) | 当連結会計年度(自 平成25年1月1日 至 平成25年12月31日) | ||||||||||
| 売上高 | 108,225 | 93,379 | |||||||||
| 売上原価 | 17,316 | 27,232 | |||||||||
| 売上総利益 | 90,909 | 66,146 | |||||||||
| 販売費及び一般管理費 | ※1,※2 2,163,459 | ※1,※2 4,488,124 | |||||||||
| 営業損失(△) | △2,072,550 | △4,421,977 | |||||||||
| 営業外収益 | |||||||||||
| 受取利息 | 283 | 1,013 | |||||||||
| 投資有価証券売却益 | - | 31,586 | |||||||||
| 助成金収入 | 94,107 | 607,264 | |||||||||
| その他 | 3,649 | 2,141 | |||||||||
| 営業外収益合計 | 98,040 | 642,006 | |||||||||
| 営業外費用 | |||||||||||
| 支払利息 | 72,307 | 225,584 | |||||||||
| 株式交付費 | 30,721 | 18,504 | |||||||||
| 為替差損 | 1,963 | 2,581 | |||||||||
| 支払手数料 | 572,891 | 121,256 | |||||||||
| その他 | - | 62 | |||||||||
| 営業外費用合計 | 677,885 | 367,989 | |||||||||
| 経常損失(△) | △2,652,395 | △4,147,960 | |||||||||
| 特別利益 | |||||||||||
| 子会社株式売却益 | - | 7,473 | |||||||||
| 特別利益合計 | - | 7,473 | |||||||||
| 税金等調整前当期純損失(△) | △2,652,395 | △4,140,486 | |||||||||
| 法人税、住民税及び事業税 | 5,700 | 30,084 | |||||||||
| 法人税等調整額 | △872 | 51,763 | |||||||||
| 法人税等合計 | 4,827 | 81,847 | |||||||||
| 少数株主損益調整前当期純損失(△) | △2,657,222 | △4,222,334 | |||||||||
| 少数株主損失(△) | △660,305 | △505,216 | |||||||||
| 当期純損失(△) | △1,996,917 | △3,717,117 | |||||||||
【連結包括利益計算書】
Section titled “【連結包括利益計算書】”| (単位:千円) | |||||||||||
| 前連結会計年度(自 平成24年1月1日 至 平成24年12月31日) | 当連結会計年度(自 平成25年1月1日 至 平成25年12月31日) | ||||||||||
| 少数株主損益調整前当期純損失(△) | △2,657,222 | △4,222,334 | |||||||||
| その他の包括利益 | |||||||||||
| その他有価証券評価差額金 | 11,932 | △5,075 | |||||||||
| その他の包括利益合計 | ※ 11,932 | ※ △5,075 | |||||||||
| 包括利益 | △2,645,290 | △4,227,410 | |||||||||
| (内訳) | |||||||||||
| 親会社株主に係る包括利益 | △1,984,985 | △3,722,193 | |||||||||
| 少数株主に係る包括利益 | △660,305 | △505,216 | |||||||||
③ 【連結株主資本等変動計算書】
Section titled “③ 【連結株主資本等変動計算書】”前連結会計年度(自 平成24年1月1日 至 平成24年12月31日)
| (単位:千円) | ||||||||
| 株主資本 | その他の包括利益累計額 | 少数株主持分 | 純資産合計 | |||||
| 資本金 | 資本剰余金 | 利益剰余金 | 株主資本合計 | その他有価証券評価差額金 | その他の包括利益累計額合計 | |||
| 当期首残高 | 3,206,400 | 2,875,400 | △3,665,213 | 2,416,586 | △6,856 | △6,856 | 414,457 | 2,824,187 |
| 当期変動額 | ||||||||
| 新株の発行 | 1,945,948 | 1,945,948 | 3,891,896 | 3,891,896 | ||||
| 当期純損失(△) | △1,996,917 | △1,996,917 | △1,996,917 | |||||
| 株主資本以外の項目の当期変動額(純額) | 11,932 | 11,932 | △361,805 | △349,872 | ||||
| 当期変動額合計 | 1,945,948 | 1,945,948 | △1,996,917 | 1,894,978 | 11,932 | 11,932 | △361,805 | 1,545,105 |
| 当期末残高 | 5,152,348 | 4,821,348 | △5,662,131 | 4,311,564 | 5,075 | 5,075 | 52,652 | 4,369,293 |
当連結会計年度(自 平成25年1月1日 至 平成25年12月31日)
| (単位:千円) | |||||||
| 株主資本 | その他の包括利益累計額 | ||||||
| 資本金 | 資本剰余金 | 利益剰余金 | 自己株式 | 株主資本合計 | その他有価証券評価差額金 | その他の包括利益累計額合計 | |
| 当期首残高 | 5,152,348 | 4,821,348 | △5,662,131 | ― | 4,311,564 | 5,075 | 5,075 |
| 当期変動額 | |||||||
| 新株の発行 | 1,804,013 | 1,804,013 | 3,608,027 | ||||
| 当期純損失(△) | △3,717,117 | △3,717,117 | |||||
| 自己株式の取得 | △197 | △197 | |||||
| 株主資本以外の項目の当期変動額(純額) | △5,075 | △5,075 | |||||
| 当期変動額合計 | 1,804,013 | 1,804,013 | △3,717,117 | △197 | △109,287 | △5,075 | △5,075 |
| 当期末残高 | 6,956,361 | 6,625,361 | △9,379,249 | △197 | 4,202,277 | ― | ― |
| 新株予約権 | 少数株主持分 | 純資産合計 | |
| 当期首残高 | ― | 52,652 | 4,369,293 |
| 当期変動額 | |||
| 新株の発行 | 3,608,027 | ||
| 当期純損失(△) | △3,717,117 | ||
| 自己株式の取得 | △197 | ||
| 株主資本以外の項目の当期変動額(純額) | 6,251 | △7,690 | △6,514 |
| 当期変動額合計 | 6,251 | △7,690 | △115,802 |
| 当期末残高 | 6,251 | 44,962 | 4,253,491 |
④ 【連結キャッシュ・フロー計算書】
Section titled “④ 【連結キャッシュ・フロー計算書】”| (単位:千円) | |||||||||||
| 前連結会計年度(自 平成24年1月1日 至 平成24年12月31日) | 当連結会計年度(自 平成25年1月1日 至 平成25年12月31日) | ||||||||||
| 営業活動によるキャッシュ・フロー | |||||||||||
| 税金等調整前当期純損失(△) | △2,652,395 | △4,140,486 | |||||||||
| 減価償却費 | 124,087 | 1,404,400 | |||||||||
| 受取利息 | △283 | △1,013 | |||||||||
| 投資有価証券売却損益(△は益) | - | △31,586 | |||||||||
| 支払利息 | 72,307 | 225,584 | |||||||||
| 支払手数料 | 572,891 | 121,256 | |||||||||
| 株式交付費 | 30,721 | 18,504 | |||||||||
| 助成金収入 | △94,107 | △607,264 | |||||||||
| 子会社株式売却損益(△は益) | - | △7,473 | |||||||||
| 売上債権の増減額(△は増加) | 941,775 | 108,225 | |||||||||
| 預り金の増減額(△は減少) | △151,635 | △2,475 | |||||||||
| その他 | 68,219 | △544,933 | |||||||||
| 小計 | △1,088,417 | △3,457,263 | |||||||||
| 利息の受取額 | 325 | 945 | |||||||||
| 利息の支払額 | △71,204 | △227,539 | |||||||||
| 助成金の受取額 | 57,917 | 204,264 | |||||||||
| 法人税等の支払額 | △5,071 | △29,718 | |||||||||
| その他 | △81,682 | △69,147 | |||||||||
| 営業活動によるキャッシュ・フロー | △1,188,134 | △3,578,459 | |||||||||
| 投資活動によるキャッシュ・フロー | |||||||||||
| 有形固定資産の取得による支出 | △8,719,266 | △3,894,139 | |||||||||
| 無形固定資産の取得による支出 | △13,883 | △425,671 | |||||||||
| 差入保証金の回収による収入 | - | 240 | |||||||||
| 差入保証金の差入による支出 | △9,864 | - | |||||||||
| 敷金の差入による支出 | △1,025 | △18,292 | |||||||||
| 敷金の回収による収入 | 3,806 | 11,985 | |||||||||
| 投資有価証券の売却による収入 | - | 167,817 | |||||||||
| 子会社株式の売却による収入 | - | 7,500 | |||||||||
| 長期前払費用の取得による支出 | △1,259 | △60 | |||||||||
| 投資活動によるキャッシュ・フロー | △8,741,491 | △4,150,619 | |||||||||
| 財務活動によるキャッシュ・フロー | |||||||||||
| 短期借入れによる収入 | - | 3,386,400 | |||||||||
| 短期借入金の返済による支出 | - | △1,950,000 | |||||||||
| 長期借入れによる収入 | 8,402,500 | 3,025,000 | |||||||||
| 長期借入金の返済による支出 | △200,000 | △350,000 | |||||||||
| 株式の発行による収入 | 3,863,274 | 3,599,274 | |||||||||
| 少数株主からの払込みによる収入 | 296,400 | 494,000 | |||||||||
| リース債務の返済による支出 | △1,175 | △90,684 | |||||||||
| その他 | - | △197 | |||||||||
| 財務活動によるキャッシュ・フロー | 12,360,998 | 8,113,793 | |||||||||
| 現金及び現金同等物の増減額(△は減少) | 2,431,372 | 384,714 | |||||||||
| 現金及び現金同等物の期首残高 | 1,451,570 | 3,882,943 | |||||||||
| 現金及び現金同等物の期末残高 | ※1 3,882,943 | ※1 4,267,657 | |||||||||
【注記事項】
Section titled “【注記事項】”(連結財務諸表作成のための基本となる重要な事項)
Section titled “(連結財務諸表作成のための基本となる重要な事項)”1. 連結の範囲に関する事項
連結子会社の数 1社
連結子会社の名称
株式会社UNIGEN 2. 連結子会社の事業年度等に関する事項
連結子会社の決算日は、連結決算日と一致しております。
3. 会計処理基準に関する事項
(1) 重要な資産の評価基準及び評価方法
たな卸資産
評価基準は原価法(収益性の低下による簿価切下げの方法)によっております。
仕掛品、原材料及び貯蔵品
個別法による原価法
(2) 重要な減価償却資産の減価償却の方法
① 有形固定資産(リース資産を除く)
定率法によっております。
但し、建物(建物附属設備を除く)は、定額法を採用しております。
なお、主な耐用年数は以下のとおりであります。
| 建物及び構築物 | 6~31年 |
|---|---|
| 機械及び装置 | 2~8年 |
| 工具、器具及び備品 | 2~15年 |
② 無形固定資産
定額法によっております。
なお、主な耐用年数は以下のとおりであります。
| 商標権 | 10年 |
|---|---|
| 自社利用のソフトウエア | 3~5年 |
| 水道施設利用権 | 15年 |
③ リース資産
リース期間を耐用年数とし、残存価額を零とする定額法によっております。
(3) 重要な引当金の計上基準
貸倒引当金
債権の貸倒れによる損失に備えるため、一般債権については貸倒実績率により、貸倒懸念債権等特定の債権については個別に回収可能性を検討し、回収不能見込額を計上しております。なお、当連結会計年度においては、貸倒実績、個別の回収不能見込額がないため、貸倒引当金を計上しておりません。
(4) 重要な繰延資産の処理方法
株式交付費
支出時に全額費用として処理しております。
(5) 重要な外貨建の資産又は負債の本邦通貨への換算の基準
外貨建金銭債権債務は、連結決算日の直物為替相場により円貨に換算し、換算差額は損益として処理しております。
(6) 連結キャッシュ・フロー計算書における資金の範囲
手許現金、随時引き出し可能な預金及び容易に換金可能であり、かつ、価値の変動について僅少なリスクしか負わない取得日から3カ月以内に償還期限の到来する短期投資からなっております。
(7) その他連結財務諸表作成のための重要な事項
消費税等の会計処理
消費税及び地方消費税の会計処理は、税抜方式によっております。
(会計上の見積の変更と区分することが困難な会計方針の変更)
当社及び連結子会社は、法人税法の改正に伴い、当連結会計年度より、平成25年1月1日以後に取得した有形固定資産について、改正後の法人税法に基づく減価償却方法に変更しております。これにより、従来の方法に比べて、当連結会計年度の営業損失、経常損失及び税金等調整前当期純損失はそれぞれ262,539千円減少しております。
(連結貸借対照表関係)
Section titled “(連結貸借対照表関係)”※1 担保資産及び担保付債務
担保に供している資産及び担保付債務は以下のとおりであります。
| 前連結会計年度(平成24年12月31日) | 当連結会計年度(平成25年12月31日) | |
|---|---|---|
| 現金及び預金 | 3,875,015千円 | 4,262,508千円 |
| 建物 | ―千円 | 2,217,472千円 |
| 計 | 3,875,015千円 | 6,479,980千円 |
| 前連結会計年度(平成24年12月31日) | 当連結会計年度(平成25年12月31日) | |
| 1年内返済予定の長期借入金 | ―千円 | 435,000千円 |
| 長期借入金 | 7,560,000千円 | 8,700,000千円 |
| 計 | 7,560,000千円 | 9,135,000千円 |
上記担保付債務は、株式会社UNIGENの銀行借入に係る債務であります。
※2 国庫補助金等により取得価額から控除した固定資産の圧縮記帳累計額は次のとおりであります。
| 前連結会計年度(平成24年12月31日) | 当連結会計年度(平成25年12月31日) | |
|---|---|---|
| 建物及び構築物 | 1,472,816千円 | 1,472,816千円 |
| 機械及び装置 | 941,546千円 | 941,546千円 |
| 工具、器具及び備品 | 480,124千円 | 480,124千円 |
| ソフトウエア | 2,467千円 | 2,467千円 |
※3 長期預り金
独立行政法人医薬基盤研究所より交付を受けた助成金であります。この助成金は助成対象医薬品が希少疾病用医薬品等の製造販売承認を受けた場合に、当該承認を受けた日から10年間にわたり当該医薬品等の売上高に一定割合を乗じた金額を助成金として交付された金額を限度として同研究所に対して納付金として納付する義務を負うものであります。
(連結損益計算書関係)
Section titled “(連結損益計算書関係)”※1 販売費及び一般管理費のうち、主要な費目及び金額は次のとおりであります。
| 前連結会計年度(自 平成24年1月1日至 平成24年12月31日) | 当連結会計年度(自 平成25年1月1日至 平成25年12月31日) | |||
| 研究開発費 | 1,649,171 | 千円 | 3,925,197 | 千円 |
※2 一般管理費に含まれる研究開発費
| 前連結会計年度(自 平成24年1月1日至 平成24年12月31日) | 当連結会計年度(自 平成25年1月1日至 平成25年12月31日) | |||
| 1,649,171 | 千円 | 3,925,197 | 千円 | |
(連結包括利益計算書関係)
Section titled “(連結包括利益計算書関係)”※ その他の包括利益に係る組替調整額及び税効果額
| 前連結会計年度(自 平成24年1月1日至 平成24年12月31日) | 当連結会計年度(自 平成25年1月1日至 平成25年12月31日) | |||||
| その他有価証券評価差額金 | ||||||
| 当期発生額 | 14,711千円 | 23,731千円 | ||||
| 組替調整額 | ―千円 | △31,586千円 | ||||
| 税効果調整前 | 14,711千円 | △7,855千円 | ||||
| 税効果額 | △2,779千円 | 2,779千円 | ||||
| その他有価証券評価差額金 | 11,932千円 | △5,075千円 | ||||
| その他の包括利益合計 | 11,932千円 | △5,075千円 | ||||
(連結株主資本等変動計算書関係)
Section titled “(連結株主資本等変動計算書関係)”前連結会計年度(自 平成24年1月1日 至 平成24年12月31日)
1. 発行済株式に関する事項
| 株式の種類 | 当連結会計年度期首 | 増加 | 減少 | 当連結会計年度末 |
|---|---|---|---|---|
| 普通株式(株) | 4,516,600 | 2,688,600 | ― | 7,205,200 |
(変動事由の概要)
第三者割当増資による増加 538,600株
一般募集による増加 2,150,000株
2. 自己株式に関する事項
該当事項はありません。
3. 新株予約権等に関する事項
該当事項はありません。
4. 配当に関する事項
(1) 配当金支払額
該当事項はありません。
(2) 基準日が当連結会計年度に属する配当のうち、配当の効力発生日が翌連結会計年度となるもの
該当事項はありません。
当連結会計年度(自 平成25年1月1日 至 平成25年12月31日)
1. 発行済株式に関する事項
| 株式の種類 | 当連結会計年度期首 | 増加 | 減少 | 当連結会計年度末 |
|---|---|---|---|---|
| 普通株式(株) | 7,205,200 | 1,220,700 | ― | 8,425,900 |
(変動事由の概要)
第三者割当増資による増加 262,600株
新株予約権行使による増加 958,100株
2. 自己株式に関する事項
| 株式の種類 | 当連結会計年度期首 | 増加 | 減少 | 当連結会計年度末 |
|---|---|---|---|---|
| 普通株式(株) | ― | 50 | ― | 50 |
(変動事由の概要)
単元未満株式買取による増加 50株
3. 新株予約権等に関する事項
| 会社名 | 内訳 | 目的となる株式の種類 | 目的となる株式の数(株) | 当連結会計年度末残高(千円) | |||
| 当連結会計年度期首 | 増加 | 減少 | 当連結会計年度末 | ||||
| 提出会社 | 行使価額修正条項付第18回新株予約権(平成25年10月17日発行) | 普通株式 | ― | 1,000,000 | 511,600 | 488,400 | 6,251 |
(変動事由の概要)
行使価額修正条項付第18回新株予約権の権利行使による減少 511,600株
4. 配当に関する事項
(1) 配当金支払額
該当事項はありません。
(2) 基準日が当連結会計年度に属する配当のうち、配当の効力発生日が翌連結会計年度となるもの
該当事項はありません。
(連結キャッシュ・フロー計算書関係)
Section titled “(連結キャッシュ・フロー計算書関係)”※1 現金及び現金同等物の期末残高と連結貸借対照表に掲記されている科目の金額との関係
| 前連結会計年度(自 平成24年1月1日至 平成24年12月31日) | 当連結会計年度(自 平成25年1月1日至 平成25年12月31日) | |
|---|---|---|
| 現金及び預金 | 3,882,943千円 | 4,267,657千円 |
| 現金及び現金同等物 | 3,882,943千円 | 4,267,657千円 |
2 重要な非資金取引の内容
ファイナンス・リース取引に係る資産及び債務の額
| 前連結会計年度(自 平成24年1月1日至 平成24年12月31日) | 当連結会計年度(自 平成25年1月1日至 平成25年12月31日) | |
|---|---|---|
| ファイナンス・リース取引に係る資産の額 | 191,323千円 | 734,625千円 |
| ファイナンス・リース取引に係る債務の額 | 190,546千円 | 643,164千円 |
(リース取引関係)
Section titled “(リース取引関係)”ファイナンス・リース取引(借主側)
所有権移転外ファイナンス・リース取引
1. リース資産内容
有形固定資産
主として、岐阜工場における生産設備であります。
2. リース資産の減価償却の方法
連結財務諸表作成のための基本となる重要な事項「3. 会計処理基準に関する事項(2)重要な減価償却資産の
減価償却の方法」に記載のとおりであります。
(金融商品関係)
Section titled “(金融商品関係)”1. 金融商品の状況に関する事項
(1) 金融商品に対する取組方針
当社グループは、必要に応じて運転資金や設備資金等を銀行借入により調達しております。また、一時的な余裕資金は短期的な預金等により運用し、投機的な取引は行わない方針であります。
(2) 金融商品の内容及びそのリスク
敷金及び保証金は、主に賃貸借契約に係る敷金・保証金として差入れており、賃貸主の信用リスクに晒されております。1年内返済予定の長期借入金及び長期借入金は、運転資金及び設備資金に係る資金調達を目的として借り入れたものであり、金利の変動に係る市場リスクに晒されております。リース債務は、主に設備投資に係る資金調達を目的としたものであり、返済日は最長で平成33年12月までの8年であります。なお、リース債務は、原則として支払リース料が定額であるため、金利変動のリスクは負っておりません。未払金、未払法人税等は1年以内の支払期日であります。
(3) 金融商品に係るリスク管理体制
敷金及び保証金は、取引開始時に契約先の信用状況の把握に努めております。借入金については、変動金利で借入を行う場合、金利の動向を把握し、短期・長期、固定金利・変動金利のバランスを勘案して対応することでリスクの軽減を図っております。
2. 金融商品の時価等に関する事項
平成25年12月31日(当期の連結決算日)における連結貸借対照表計上額、時価及びこれらの差額については、次のとおりであります。
前連結会計年度(平成24年12月31日)
(単位:千円)
| 連結貸借対照表計上額 | 時価 | 差額 | |
|---|---|---|---|
| (1) 現金及び預金 | 3,882,943 | 3,882,943 | ― |
| (2) 売掛金 | 108,225 | 108,225 | ― |
| (3) 未収消費税等 | 91,948 | 91,948 | ― |
| (4) 敷金及び保証金 | 60,817 | 55,753 | △5,064 |
| 資産計 | 4,143,933 | 4,138,869 | △5,064 |
| (1) 未払金 | (136,252) | (136,252) | ― |
| (2) 未払法人税等 | (22,629) | (22,629) | ― |
| (3) 短期借入金 | ― | ― | ― |
| (4) 長期借入金(1年内返済予定の長期借入金含む) | (8,910,000) | (8,914,233) | 4,233 |
| (5) リース債務(1年内返済予定のリース債務含む) | (190,546) | (191,354) | 808 |
| 負債計 | (9,259,427) | (9,264,468) | 5,041 |
当連結会計年度(平成25年12月31日)
(単位:千円)
| 連結貸借対照表計上額 | 時価 | 差額 | |
|---|---|---|---|
| (1) 現金及び預金 | 4,267,657 | 4,267,657 | ― |
| (2) 売掛金 | ― | ― | ― |
| (3) 未収消費税等 | 789,050 | 789,050 | ― |
| (4) 敷金及び保証金 | 66,884 | 62,305 | △4,579 |
| 資産計 | 5,123,591 | 5,119,012 | △4,579 |
| (1) 未払金 | (382,348) | (382,348) | ― |
| (2) 未払法人税等 | (29,631) | (29,631) | ― |
| (3) 短期借入金 | (1,484,300) | (1,484,300) | ― |
| (4) 長期借入金(1年内返済予定の長期借入金含む) | (11,585,000) | (11,591,606) | 6,606 |
| (5) リース債務(1年内返済予定のリース債務含む) | (643,165) | (645,566) | 2,401 |
| 負債計 | (14,124,444) | (14,133,450) | 9,006 |
(注)1. 負債に計上されるものについては、( )で表示しております。
2. 金融商品の時価の算定方式に関する事項
資産
(1) 現金及び預金、(2) 売掛金、(3) 未収消費税等
これらは短期間で決済されるため、時価は帳簿価額にほぼ等しいことから、当該帳簿価額によっております。
(4) 敷金及び保証金
敷金及び保証金の時価については、返済時期を見積もった上で、将来キャッシュ・フローを無リスクの利子率で割引いて算定する方法によっております。
負債
(1) 未払金、(2) 未払法人税等、(3) 短期借入金
これらは短期間で決済されるため、時価は帳簿価額にほぼ等しいことから、当該帳簿価額によっております。
(4) 長期借入金(1年内返済予定の長期借入金含む)
長期借入金については、元利金の合計金額を同様の新規借入を行った場合に合理的に見積もられる利率で割引いて算定する方法によっております。
(5) リース債務(1年内返済予定のリース債務含む)
リース債務の時価については、元利金の合計額を同様の新規リース取引を行った場合に合理的に見積もられる利率で割引いて算定する方法によっております。
3. 時価を把握することが極めて困難と認められる金融商品の連結貸借対照表計上額
(単位:千円)
| 区分 | 平成24年12月31日 | 平成25年12月31日 |
|---|---|---|
| 非上場株式 | 144,086 | ― |
上記については、市場価格がなく、かつ、将来キャッシュ・フローを見積もることができず、時価を
把握することが極めて困難と認められるため上表には含めておりません。
4. 金銭債権の連結決算日後の償還予定額
前連結会計年度(平成24年12月31日)
| 1年以内(千円) | 1年超5年以内(千円) | 5年超10年以内(千円) | 10年超(千円) | |
|---|---|---|---|---|
| 現金及び預金 | 3,882,943 | ― | ― | ― |
| 売掛金 | 108,225 | ― | ― | ― |
| 未収消費税等 | 91,948 | ― | ― | ― |
| 敷金及び保証金 | 240 | 29,982 | ― | 30,595 |
| 合計 | 4,083,356 | 29,982 | ― | 30,595 |
当連結会計年度(平成25年12月31日)
| 1年以内(千円) | 1年超5年以内(千円) | 5年超10年以内(千円) | 10年超(千円) | |
|---|---|---|---|---|
| 現金及び預金 | 4,267,657 | ― | ― | ― |
| 未収消費税等 | 789,050 | ― | ― | ― |
| 敷金及び保証金 | ― | 29,667 | ― | 37,217 |
| 合計 | 5,056,707 | 29,667 | ― | 37,217 |
5. 長期借入金、リース債務及びその他の有利子負債の連結決算日後の償還予定額
前連結会計年度(平成24年12月31日)
| 1年以内(千円) | 1年超 2年以内(千円) | 2年超 3年以内(千円) | 3年超 4年以内(千円) | 4年超 5年以内(千円) | 5年超(千円) | |
|---|---|---|---|---|---|---|
| 長期借入金 | 1,100,000 | 435,000 | 291,000 | 939,000 | 889,000 | 5,256,000 |
| リース債務 | 25,354 | 24,376 | 25,744 | 27,190 | 28,716 | 59,163 |
| 合計 | 1,125,354 | 459,376 | 316,744 | 966,190 | 917,716 | 5,315,163 |
当連結会計年度(平成25年12月31日)
| 1年以内(千円) | 1年超 2年以内(千円) | 2年超 3年以内(千円) | 3年超 4年以内(千円) | 4年超 5年以内(千円) | 5年超(千円) | |
|---|---|---|---|---|---|---|
| 短期借入金 | 1,484,300 | ― | ― | ― | ― | ― |
| 長期借入金 | 2,710,000 | 336,000 | 1,119,000 | 1,069,000 | 1,044,000 | 5,307,000 |
| リース債務 | 94,071 | 99,257 | 104,730 | 110,506 | 113,349 | 121,249 |
| 合計 | 4,288,071 | 435,257 | 1,223,730 | 1,179,506 | 1,157,349 | 5,428,249 |
(有価証券関係)
Section titled “(有価証券関係)”前連結会計年度(自 平成24年1月1日 至 平成24年12月31日)
投資有価証券(連結貸借対照表計上額 投資有価証券 144,086千円)は、市場価格がなく、時価を把握すること
が極めて困難と認められることから、記載しておりません。
当連結会計年度(自 平成25年1月1日 至 平成25年12月31日)
連結会計年度中に売却した投資有価証券
| 区分 | 売却額(千円) | 売却益の合計額(千円) | 売却損の合計額(千円) |
|---|---|---|---|
| 株式 | 167,817 | 31,586 | ― |
(デリバティブ取引関係)
Section titled “(デリバティブ取引関係)”当社グループは、デリバティブ取引を利用していないため、該当事項はありません。
(退職給付関係)
Section titled “(退職給付関係)”該当事項はありません。
(ストック・オプション等関係)
Section titled “(ストック・オプション等関係)”1. 費用計上額及び科目名
該当事項はありません。
2. ストック・オプションの内容、規模及びその変動状況
(1) ストック・オプションの内容
| 第2回新株予約権 | 第3回新株予約権 | |
|---|---|---|
| 付与対象者の区分及び人数(名) | 当社取締役1、当社従業員2、社外協力者2 | 当社取締役1、当社従業員2、社外協力者1 |
| 株式の種類及び付与数(株) | 普通株式 47,500(注)1、2 | 普通株式 22,500 (注)1、2 |
| 付与日 | 平成17年9月30日 | 平成18年1月24日 |
| 権利確定条件 | 新株予約権発行時において、当社の取締役及び従業員であった者は、新株予約権行使時においても当社の役員または従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。 | 新株予約権発行時において、当社の取締役及び従業員であった者は、新株予約権行使時においても当社の役員または従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。 |
| 対象勤務期間 | ― | ― |
| 権利行使期間 | 平成19年7月29日から平成27年7月28日まで | 平成19年7月29日から平成27年7月28日まで |
(注) 1. 当社は、平成18年9月13日をもって1株を10株に、平成23年8月24日をもって1株を50株に分割して
おります。その結果、ストック・オプションの付与株式数が調整されております。
2. 株式数に換算しております。
| 第4回新株予約権 | 第5回新株予約権 | |
|---|---|---|
| 付与対象者の区分及び人数(名) | 当社従業員1、社外協力者1 | 当社取締役6、当社監査役1、当社従業員6、社外協力者2 |
| 株式の種類及び付与数(株) | 普通株式 5,000 (注)1、2 | 普通株式 175,000 (注)1、2 |
| 付与日 | 平成18年6月16日 | 平成18年6月16日 |
| 権利確定条件 | 新株予約権発行時において、当社の取締役及び従業員であった者は、新株予約権行使時においても当社の役員または従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。 | 新株予約権発行時において、当社の取締役及び従業員であった者は、新株予約権行使時においても当社の役員または従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。 |
| 対象勤務期間 | ― | ― |
| 権利行使期間 | 平成19年7月29日から平成27年7月28日まで | 平成19年12月29日から平成27年12月28日まで |
(注) 1. 当社は、平成18年9月13日をもって1株を10株に、平成23年8月24日をもって1株を50株に分割して
おります。その結果、ストック・オプションの付与株式数が調整されております。
2. 株式数に換算しております。
| 第6回新株予約権 | 第7回新株予約権 | |
|---|---|---|
| 付与対象者の区分及び人数(名) | 当社取締役5、当社監査役3、当社従業員10、社外協力者3 | 当社従業員1、社外協力者1 |
| 株式の種類及び付与数(株) | 普通株式 53,000 (注)1、2 | 普通株式 20,000 (注)1、2 |
| 付与日 | 平成18年9月22日 | 平成18年10月2日 |
| 権利確定条件 | 新株予約権発行時において、当社の取締役及び従業員であった者は、新株予約権行使時においても当社の役員または従業員であることを要する。ただし、任期満了による退任その他正当な理由のあると当会社の取締役会で認めた場合ならびに相続により新株予約権を取得した場合は、この限りではない。 | 新新株予約権発行時において、当会社の取締役及び従業員であった者は、新株予約権行使時においても当会社の役員または従業員であることを要する。ただし、任期満了による退任その他正当な理由があると当会社の取締役会で認めた場合ならびに相続により新株予約権を取得した場合は、この限りではない。 |
| 対象勤務期間 | ― | ― |
| 権利行使期間 | 平成20年9月23日から平成28年7月12日まで | 平成20年10月3日から平成28年7月12日まで |
(注) 1. 当社は、平成23年8月24日をもって1株を50株に分割しております。その結果、ストック・オプショ
ンの付与株式数が調整されております。
2. 株式数に換算しております。
| 第8回新株予約権 | 第9回新株予約権 | |
|---|---|---|
| 付与対象者の区分及び人数(名) | 当社取締役1、当社従業員6、社外協力者1 | 社外協力者1 |
| 株式の種類及び付与数(株) | 普通株式 66,000 (注)1、2 | 普通株式 225,000(注)1、2 |
| 付与日 | 平成19年6月14日 | 平成19年6月14日 |
| 権利確定条件 | 新株予約権発行時において、当社の取締役及び従業員であった者は、新株予約権行使時においても当社の役員または従業員であることを要する。ただし、任期満了による退任その他正当な理由のあると当会社の取締役会で認めた場合ならびに相続により新株予約権を取得した場合は、この限りではない。 | 新新株予約権者が、新株予約権者と当会社との間で締結したライセンス契約に違反した場合は、新株予約権を行使できない。 |
| 対象勤務期間 | ― | ― |
| 権利行使期間 | 平成21年6月15日から平成28年11月24日まで | 平成19年6月14日から平成28年11月24日まで |
(注) 1. 当社は、平成23年8月24日をもって1株を50株に分割しております。その結果、ストック・オプショ
ンの付与株式数が調整されております。
2. 株式数に換算しております。
| 第10回新株予約権 | 第11回新株予約権 | |
|---|---|---|
| 付与対象者の区分及び人数(名) | 当社取締役3、当社従業員9 | 当社取締役1 |
| 株式の種類及び付与数(株) | 普通株式 84,000 (注)1、2 | 普通株式 30,000(注)1、2 |
| 付与日 | 平成19年11月15日 | 平成22年3月29日 |
| 権利確定条件 | 新株予約権発行時において、当会社の取締役及び従業員であった者は、新株予約権行使時においても当会社の取締役、監査役、執行役又は従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。 | 新株予約権者は、新株予約権行使時においても当会社の取締役、監査役、執行役又は従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。 |
| 対象勤務期間 | ― | ― |
| 権利行使期間 | 平成21年6月15日から平成28年11月24日まで | 平成24年1月27日から平成32年1月26日まで |
(注) 1. 当社は、平成23年8月24日をもって1株を50株に分割しております。その結果、ストック・オプショ
ンの付与株式数が調整されております。
2. 株式数に換算しております。
| 第12回新株予約権 | 第13回新株予約権 | |
|---|---|---|
| 付与対象者の区分及び人数(名) | 当社従業員5 | 当社従業員4 |
| 株式の種類及び付与数(株) | 普通株式 9,000 (注)1、2 | 普通株式 10,000 (注)1、2 |
| 付与日 | 平成22年3月29日 | 平成22年7月16日 |
| 権利確定条件 | 新株予約権発行時において、当会社の従業員であった者は、新株予約権行使時においても当会社又は当会社子会社(会社法第2条第3号に定める子会社を意味する。)の取締役、監査役、執行役又は従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。 | 新株予約権発行時において、当会社の従業員であった者は、新株予約権行使時においても当会社又は当会社子会社(会社法第2条第3号に定める子会社を意味する。)の取締役、監査役、執行役又は従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。 |
| 対象勤務期間 | ― | ― |
| 権利行使期間 | 平成24年1月27日から平成32年1月26日まで | 平成24年1月27日から平成32年1月26日まで |
(注) 1. 当社は、平成23年8月24日をもって1株を50株に分割しております。その結果、ストック・オプショ
ンの付与株式数が調整されております。
2. 株式数に換算しております。
| 第14回新株予約権 | 第15回新株予約権 | |
|---|---|---|
| 付与対象者の区分及び人数(名) | 当社従業員9 | 当社取締役2 |
| 株式の種類及び付与数(株) | 普通株式 27,000 (注)1、2 | 普通株式 10,000 (注)1、2 |
| 付与日 | 平成22年8月13日 | 平成22年8月31日 |
| 権利確定条件 | 新株予約権発行時において、当会社の従業員であった者は、新株予約権行使時においても当会社又は当会社子会社(会社法第2条第3号に定める子会社を意味する。)の取締役、監査役、執行役又は従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。 | 新株予約権者は、新株予約権行使時においても当会社の取締役、監査役、執行役又は従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。 |
| 対象勤務期間 | ― | ― |
| 権利行使期間 | 平成24年1月27日から平成32年1月26日まで | 平成24年1月27日から平成32年1月26日まで |
(注) 1. 当社は、平成23年8月24日をもって1株を50株に分割しております。その結果、ストック・オプショ
ンの付与株式数が調整されております。
2. 株式数に換算しております。
| 第16回新株予約権 | 第17回新株予約権 | |
|---|---|---|
| 付与対象者の区分及び人数(名) | 当社従業員1 | 当社従業員1 |
| 株式の種類及び付与数(株) | 普通株式 1,000 (注)1、2 | 普通株式 3,000 (注)1、2 |
| 付与日 | 平成22年9月21日 | 平成22年10月1日 |
| 権利確定条件 | 新株予約権発行時において、当会社の従業員であった者は、新株予約権行使時においても当会社又は当会社子会社(会社法第2条第3号に定める子会社を意味する。)の取締役、監査役、執行役又は従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。 | 新株予約権発行時において、当会社の従業員であった者は、新株予約権行使時においても当会社又は当会社子会社(会社法第2条第3号に定める子会社を意味する。)の取締役、監査役、執行役又は従業員であることを要する。ただし、任期満了による退任その他正当な理由のある場合ならびに相続により新株予約権を取得した場合は、この限りではない。 |
| 対象勤務期間 | ― | ― |
| 権利行使期間 | 平成24年1月27日から平成32年1月26日まで | 平成24年1月27日から平成32年1月26日まで |
(注) 1. 当社は、平成23年8月24日をもって1株を50株に分割しております。その結果、ストック・オプショ
ンの付与株式数が調整されております。
2. 株式数に換算しております。
(2) ストック・オプションの規模及びその変動状況
① ストック・オプションの数
当連結会計年度(平成25年12月期)において存在したストック・オプションを対象とし、ストック・オプションの数については、株式数に換算して記載しております。
| 第2回 | 第3回 | 第4回 | 第5回 | 第6回 | |
|---|---|---|---|---|---|
| 決議年月日 | 平成17年7月29日 | 平成17年7月29日 | 平成17年7月29日 | 平成17年12月29日 | 平成18年7月12hi |
| 権利確定前 | |||||
| 前連結会計年度末(株) | ― | ― | ― | ― | ― |
| 付与(株) | ― | ― | ― | ― | ― |
| 失効(株) | ― | ― | ― | ― | ― |
| 権利確定(株) | ― | ― | ― | ― | ― |
| 未確定残(株) | ― | ― | ― | ― | ― |
| 権利確定後 | |||||
| 前連結会計年度末(株) | 20,000 | 15,000 | 2,500 | 70,000 | 72,500 |
| 権利確定(株) | ― | ― | ― | ― | ― |
| 権利行使(株) | 20,000 | 15,000 | ― | 44,000 | 19,500 |
| 失効(株) | ― | ― | ― | ― | ― |
| 未行使残(株) | ― | ― | 2,500 | 26,000 | 53,000 |
| 第7回 | 第8回 | 第9回 | 第10回 | 第11回 | |
|---|---|---|---|---|---|
| 決議年月日 | 平成18年7月12日 | 平成18年11月24日 | 平成19年6月14日 | 平成18年11月24日 | 平成22年1月26hi |
| 権利確定前 | |||||
| 前連結会計年度末(株) | ― | ― | ― | ― | ― |
| 付与(株) | ― | ― | ― | ― | ― |
| 失効(株) | ― | ― | ― | ― | ― |
| 権利確定(株) | ― | ― | ― | ― | ― |
| 未確定残(株) | ― | ― | ― | ― | ― |
| 権利確定後 | |||||
| 前連結会計年度末(株) | 20,000 | 24,500 | 225,000 | 42,000 | 30,000 |
| 権利確定(株) | ― | ― | ― | ― | ― |
| 権利行使(株) | 20,000 | 24,500 | 225,000 | 38,000 | 5,000 |
| 失効(株) | ― | ― | ― | 4,000 | ― |
| 未行使残(株) | ― | ― | ― | ― | 25,000 |
| 第12回 | 第13回 | 第14回 | 第15回 | 第16回 | |
|---|---|---|---|---|---|
| 決議年月日 | 平成22年1月26日 | 平成22年1月26日 | 平成22年1月26日 | 平成22年1月26日 | 平成22年1月26hi |
| 権利確定前 | |||||
| 前連結会計年度末(株) | ― | ― | ― | ― | ― |
| 付与(株) | ― | ― | ― | ― | ― |
| 失効(株) | ― | ― | ― | ― | ― |
| 権利確定(株) | ― | ― | ― | ― | ― |
| 未確定残(株) | ― | ― | ― | ― | ― |
| 権利確定後 | |||||
| 前連結会計年度末(株) | 8,000 | 3,000 | 25,000 | 10,000 | 1,000 |
| 権利確定(株) | ― | ― | ― | ― | ― |
| 権利行使(株) | 8,000 | 1,000 | 17,500 | 5,000 | 1,000 |
| 失効(株) | ― | ― | 3,000 | ― | ― |
| 未行使残(株) | ― | 2,000 | 4,500 | 5,000 | ― |
| 第17回 | |
|---|---|
| 決議年月日 | 平成22年1月26日 |
| 権利確定前 | |
| 前連結会計年度末(株) | ― |
| 付与(株) | ― |
| 失効(株) | ― |
| 権利確定(株) | ― |
| 未確定残(株) | ― |
| 権利確定後 | |
| 前連結会計年度末(株) | 3,000 |
| 権利確定(株) | ― |
| 権利行使(株) | 3,000 |
| 失効(株) | ― |
| 未行使残(株) | ― |
(注) 当社は、平成18年9月13日をもって1株を10株に分割しております。その結果、第1回から第5回までのストッ
ク・オプションの株式数が調整されております。また、平成23年8月24日をもって1株を50株に分割しておりま
す。その結果、第1回から第17回までのストック・オプションの株式数が調整されております。
② 単価情報
| 第2回 | 第3回 | 第4回 | 第5回 | 第6回 | |
|---|---|---|---|---|---|
| 決議年月日 | 平成17年7月29日 | 平成17年7月29日 | 平成17年7月29日 | 平成17年12月29日 | 平成18年7月12hi |
| 権利行使価格(円) | 560 | 560 | 560 | 700 | 800 |
| 行使時平均株価(円) | 4,280 | 3,409 | ― | 3,966 | 3,643 |
| 付与日における公正な評価単価(円) | ― | ― | ― | ― | ― |
| 第7回 | 第8回 | 第9回 | 第10回 | 第11回 | |
|---|---|---|---|---|---|
| 決議年月日 | 平成18年7月12日 | 平成18年11月24日 | 平成19年6月14日 | 平成18年11月24日 | 平成22年1月26日 |
| 権利行使価格(円) | 800 | 1,680 | 1,680 | 1,680 | 2,200 |
| 行使時平均株価(円) | 3,643 | 4,127 | 6,607 | 3,643 | 3,643 |
| 付与日における公正な評価単価(円) | ― | ― | ― | ― | ― |
| 第12回 | 第13回 | 第14回 | 第15回 | 第16回 | |
|---|---|---|---|---|---|
| 決議年月日 | 平成22年1月26日 | 平成22年1月26日 | 平成22年1月26日 | 平成22年1月26日 | 平成22年1月26日 |
| 権利行使価格(円) | 2,200 | 2,200 | 2,200 | 2,200 | 2,200 |
| 行使時平均株価(円) | 4,013 | 3,643 | 3,812 | 3,643 | 3,643 |
| 付与日における公正な評価単価(円) | ― | ― | ― | ― | ― |
| 第17回 | ||||
|---|---|---|---|---|
| 決議年月日 | 平成22年1月26日 | |||
| 権利行使価格(円) | 2,200 | |||
| 行使時平均株価(円) | ― | |||
| 付与日における公正な評価単価(円) | ― |
3. 当連結会計年度に付与されたストック・オプションの公正な評価単価の見積方法
該当事項はありません。
4. ストック・オプションの権利確定数の見積方法
基本的には、将来の失効数の合理的な見積りは困難であるため、実績の失効数のみ反映させる方法を採用して
おります。
5. ストック・オプションの本源的価値より算定を行う場合の当連結会計年度末における本源的価値の合計額及び権
利行使されたストック・オプションの権利行使日における本源的価値
① 当連結会計年度末における本源的価値の合計額 217,600千円
② 当連結会計年度に権利行使されたストック・オプションの
権利行使日における本源的価値の合計額 2,239,300千円
(税効果会計関係)
Section titled “(税効果会計関係)”1. 繰延税金資産及び繰延税金負債の発生の主な原因別の内訳
| 前連結会計年度(平成24年12月31日) | 当連結会計年度(平成25年12月31日) | |
|---|---|---|
| 繰延税金資産(流動) | ||
| 貯蔵品 | ―千円 | 561,857千円 |
| 未払事業所税 | 397千円 | 666千円 |
| 未払事業税 | 6,396千円 | 8,857千円 |
| その他 | △18千円 | 2,219千円 |
| 小計 | 6,775千円 | 573,601千円 |
| 繰延税金資産(固定) | ||
| 繰延資産償却超過額 | 132,840千円 | 82,775千円 |
| 減価償却超過額 | 7,045千円 | 6,656千円 |
| 繰越欠損金 | 2,051,205千円 | 3,003,757千円 |
| 長期預り金 | 120,409千円 | 120,409千円 |
| その他 | 40,294千円 | 71,976千円 |
| 小計 | 2,351,795千円 | 3,285,575千円 |
| 評価性引当額 | △2,358,570千円 | △3,859,177千円 |
| 繰延税金資産の合計 | ―千円 | ―千円 |
| 繰延税金負債(固定) | ||
| 資産除去債務 | 7,350千円 | 56,334千円 |
| 小計 | 7,350千円 | 56,334千円 |
| 繰延税金負債の合計 | 7,350千円 | 56,334千円 |
2. 法定実効税率と税効果会計適用後の法人税等の負担率との差異の原因となった主な項目別の内訳
| 前連結会計年度(平成24年12月31日) | 当連結会計年度(平成25年12月31日) | |
| 法定実効税率 | 40.4% | 37.8% |
| (調整) | ||
| 交際費等永久に損金に | △0.1% | △0.4% |
| 算入されない項目 | ||
| 住民税均等割 | △0.2% | △0.1% |
| 評価性引当額 | △34.8% | △36.2% |
| 税率変更による影響 | △5.8% | ― |
| 外国源泉所得税 | ― | △0.6% |
| その他 | 0.3% | △2.3% |
| 税効果会計適用後の法人税等の | △0.2% | △2.0% |
| 負担率 |
(資産除去債務関係)
Section titled “(資産除去債務関係)”資産除去債務のうち連結貸借対照表に計上しているもの
(1) 当該資産除去債務の概要
工場等の不動産賃貸借契約に伴う原状回復義務及び当社グループ所有の建物に関するリサイクル費用であり
ます。
(2) 当該資産除去債務の金額の算定方法
物件ごとに使用見積期間を見積り、対応する国債の利回りで割引いて資産除去債務の金額を計算しておりま
す。
(3) 当該資産除去債務の総額の増減
| 前連結会計年度(自 平成24年1月1日 至 平成24年12月31日) | 当連結会計年度(自 平成25年1月1日 至 平成25年12月31日) | |
| 期首残高 | 19,605千円 | 20,157千円 |
| 有形固定資産の取得に伴う増加額 | ―千円 | 152,123千円 |
| 時の経過による増減額 | 551千円 | 3,419千円 |
| (△は減少) | ||
| 資産除去債務の履行による減少額 | ―千円 | △7,600千円 |
| 期末残高 | 20,157千円 | 168,099千円 |
(セグメント情報等)
Section titled “(セグメント情報等)”【セグメント情報】
当社グループは医療用医薬品の研究開発の単一セグメントであるため、記載を省略しております。
【関連情報】
前連結会計年度(自 平成24年1月1日 至 平成24年12月31日)
1. 製品及びサービスごとの情報
当社グループは医療用医薬品の研究開発の単一セグメントであるため、記載を省略しております。
2. 地域ごとの情報
(1) 売上高
(単位:千円)
| 東アジア | 計 |
|---|---|
| 108,225 | 108,225 |
(2) 有形固定資産
本邦以外に所在している有形固定資産がないため、記載を省略しております。
3. 主要な顧客ごとの情報
| 顧客の氏名又は名称 | 売上高(千円) |
|---|---|
| 日東製薬株式会社 | 108,225 |
(注) 当社グループは単一セグメントとしているため、関連するセグメント名は省略しております。
当連結会計年度(自 平成25年1月1日 至 平成25年12月31日)
1. 製品及びサービスごとの情報
当社グループは医療用医薬品の研究開発の単一セグメントであるため、記載を省略しております。
2. 地域ごとの情報
(1) 売上高
(単位:千円)
| 日本 | 東アジア | 計 |
|---|---|---|
| 21,211 | 72,167 | 93,379 |
(2) 有形固定資産
本邦以外に所在している有形固定資産がないため、記載を省略しております。
3. 主要な顧客ごとの情報
| 顧客の氏名又は名称 | 売上高(千円) |
|---|---|
| 國光生物科技股份有限公司 | 50,000 |
| 日東製薬株式会社 | 22,167 |
(注) 当社グループは単一セグメントとしているため、関連するセグメント名は省略しております。 【報告セグメントごとの固定資産の減損損失に関する情報】
該当事項はありません。 【報告セグメントごとののれんの償却額及び未償却残高に関する情報】
該当事項はありません。
【報告セグメントごとの負ののれん発生益に関する情報】
該当事項はありません。
【関連当事者情報】
Section titled “【関連当事者情報】”1. 関連当事者との取引
(1) 連結財務諸表提出会社と関連当事者の取引
(ア) 連結財務諸表提出会社の役員及び主要株主(個人の場合に限る)等
前連結会計年度(自 平成24年1月1日 至 平成24年12月31日)
該当事項はありません。
当連結会計年度(自 平成25年1月1日 至 平成25年12月31日)
| 種類 | 会社等の名称又は氏名 | 所在地 | 資本金又は出資金(千円) | 事業の内容又は職業 | 議決権等の所有(被所有)割合(%) | 関連当事者との関係 | 取引の内容 | 取引金額(千円) | 科目 | 期末残高(千円) |
|---|---|---|---|---|---|---|---|---|---|---|
| 役員 | 道下 眞弘 | ― | ― | (注)1 | (被所有)直接0.0 | ― | ストックオプションの権利行使 | 11,700(16,500株) | ― | ― |
| 役員 | 平野 達義 | ― | ― | 当社代表取締役会長兼社長 | (被所有)直接0.0 | ― | ストックオプションの権利行使 | 11,000(5,000株) | ― | ― |
| 役員 | 中田 文久 | ― | ― | 当社取締役 | (被所有)直接0.0 | ― | ストックオプションの権利行使 | 11,000(5,000株) | ― | ― |
| 役員 | 橋本 裕之 | ― | ― | 当社取締役 | (被所有)直接0.2 | ― | ストックオプションの権利行使 | 11,100(13,000株) | ― | ― |
| 役員 | 高木 淳一 | ― | ― | 当社常勤監査役 | (被所有)直接0.0 | ― | ストックオプションの権利行使 | 50,400(30,000株) | ― | ― |
(注) 1. 道下眞弘は平成25年8月5日をもって当社代表取締役会長兼社長を辞任しており、上記の金額は当連結会計
年度の在任期間に係るものであります。
2. 平成17年12月29日、平成18年7月12日、平成18年11月24日及び平成22年1月26日開催の株主総会の決議に基
づき付与されたストックオプションの当連結会計年度における権利行使を記載しております。
(2) 連結財務諸表提出会社の連結子会社と関連当事者との取引
(ア) 連結財務諸表提出会社の親会社及び主要株主(会社等に限る)等
前連結会計年度(自 平成24年1月1日 至 平成24年12月31日)
| 種類 | 会社等の名称又は氏名 | 所在地 | 資本金又は出資金(千円) | 事業の内容又は職業 | 議決権等の所有(被所有)割合(%) | 関連当事者との関係 | 取引の内容 | 取引金額(千円) | 科目 | 期末残高(千円) |
| 主要株主(法人) | 株式会社IHI | 東京都江東区 | 95,762,421 | 総合重工 | (被所有)直接10.04間接3.14 | 協業に関する基本協定の締結 | 借入金に係る債務被保証 | 5,000,000 | 前払費用 | 12,328 |
| 増資の引受 | 298,500 | ― | ― |
取引条件及び取引条件の決定方針等
(注) 1. 価格その他の取引条件は、市場実勢を勘案して当社グループが希望価格を提示し、価格交渉の上決定してお
ります。
2. 取引金額には消費税等を含めておりません。
当連結会計年度(自 平成25年1月1日 至 平成25年12月31日)
該当事項はありません。
(1株当たり情報)
Section titled “(1株当たり情報)”| 前連結会計年度(自 平成24年1月1日 至 平成24年12月31日) | 当連結会計年度(自 平成25年1月1日 至 平成25年12月31日) |
|---|---|
| 1株当たり純資産額 599円10銭 | 1株当たり純資産額 498円74銭 |
| 1株当たり当期純損失金額 420円61銭 | 1株当たり当期純損失金額 491円59銭 |
(注) 1. 潜在株式調整後1株当たり当期純利益金額については、潜在株式が存在するものの、1株当たり当期純損失金額を計上しているため記載しておりません。
2. 1株当たり当期純損失金額の算定上の基礎は、以下のとおりであります。
| 項目 | 前連結会計年度(自 平成24年1月1日 至 平成24年12月31日) | 当連結会計年度(自 平成25年1月1日 至 平成25年12月31日) |
| 1株当たり当期純損失金額 | ||
| 当期純損失(△)(千円) | △1,996,917 | △3,717,117 |
| 普通株式に帰属しない金額(千円) | ― | ― |
| 普通株式に係る当期純損失(△)(千円) | △1,996,917 | △3,717,117 |
| 普通株式の期中平均株式数(株) | 4,747,654 | 7,561,372 |
| 希薄化効果を有しないため、潜在株式調整後1株当たり当期純利益金額の算定に含まれなかった潜在株式の概要 | ― | |
3. 1株当たり純資産額の算定上の基礎は、以下のとおりであります。
| 項目 | 前連結会計年度(平成24年12月31日) | 当連結会計年度(平成25年12月31日) |
|---|---|---|
| 純資産の部の合計額(千円) | 4,369,293 | 4,253,491 |
| 純資産の部の合計額から控除する金額(千円) | 52,652 | 51,213 |
| (うち新株予約権(千円)) | ― | (6,251) |
| (うち少数株主持分(千円)) | (52,652) | (44,962) |
| 普通株式に係る期末の純資産額(千円) | 4,316,640 | 4,202,277 |
| 1株当たり純資産額の算定に用いられた普通株式の数(株) | 7,205,200 | 8,425,850 |
(重要な後発事象)
Section titled “(重要な後発事象)”補助金の補助金額決定
当社子会社である株式会社UNIGENは、経済産業省「平成23年度国内立地推進事業費補助金」の補助金額確定通知書を受領し、補助金の交付を受けました。
(1) 補助金額確定通知書受領日 平成26年2月14日
(2) 補助金の入金日 平成26年2月28日
(3) 補助金の交付額 2,213,799千円
(4) 損益に与える影響 翌連結会計年度において、国庫補助金等による圧縮記帳処理を行い、補助
金受取による特別利益及び圧縮記帳による特別損失を計上する予定であり
ます。
⑤ 【連結附属明細表】
Section titled “⑤ 【連結附属明細表】”【社債明細表】
Section titled “【社債明細表】”該当事項はありません。
【借入金等明細表】
Section titled “【借入金等明細表】”| 区分 | 当期首残高(千円) | 当期末残高(千円) | 平均利率(%) | 返済期限 |
|---|---|---|---|---|
| 短期借入金 | ― | 1,484,300 | 1.9 | ― |
| 1年以内に返済予定の長期借入金 | 1,100,000 | 2,710,000 | 1.5 | ― |
| 1年以内に返済予定のリース債務 | 25,354 | 94,071 | ― | ― |
| 長期借入金(1年以内に返済予定のものを除く) | 7,810,000 | 8,875,000 | 1.5 | 平成27年~平成35年 |
| リース債務(1年以内に返済予定のものを除く) | 165,192 | 549,093 | ― | 平成27年~平成31年 |
| 合計 | 9,100,546 | 13,712,464 | ― | ― |
(注) 1.「平均利率」については、借入金の期末残高に対する加重平均利率を記載しております。なお、リース債務については、リース料総額に含まれる利息相当額を控除する前の金額でリース債務を連結貸借対照表に計上しているため、「平均利率」を記載しておりません。
2. 長期借入金及びリース債務(1年以内に返済予定のものを除く)の連結決算日後5年内における1年ごとの返済予定額は以下のとおりであります。
| 区分 | 1年超2年以内(千円) | 2年超3年以内(千円) | 3年超4年以内(千円) | 4年超5年以内(千円) |
|---|---|---|---|---|
| 長期借入金 | 336,000 | 1,119,000 | 1,069,000 | 1,044,000 |
| リース債務 | 99,257 | 104,730 | 110,506 | 113,349 |
【資産除去債務明細表】
Section titled “【資産除去債務明細表】”本明細表に記載すべき事項は、連結財務諸表規則第15条の23に規定する注記事項として記載しているため、記載を省略しております。
(2)【その他】
Section titled “(2)【その他】”①当連結会計年度における四半期情報等
| (累計期間) | 第1四半期 | 第2四半期 | 第3四半期 | 当連結会計年度 | |
| 売上高 | (千円) | 24,331 | 24,331 | 24,331 | 93,379 |
| 税金等調整前四半期(当期)純損失金額(△) | (千円) | △698,128 | △1,641,025 | △3,248,662 | △4,140,486 |
| 四半期(当期)純損失金額(△) | (千円) | △544,062 | △1,166,159 | △2,773,039 | △3,717,117 |
| 1株当たり四半期(当期)純損失金額(△) | (円) | △75.43 | △158.58 | △372.01 | △491.59 |
| (会計期間) | 第1四半期 | 第2四半期 | 第3四半期 | 第4四半期 | |
| 1株当たり四半期純損失金額(△) | (円) | △75.43 | △83.57 | △210.63 | △119.81 |
②シンジケートローン契約の締結
当社子会社である株式会社UNIGENは、平成26年3月31日付で、既存借入金のリファイナンス及び運転資金の調達
を目的として、株式会社三井住友銀行をアレンジャーとする金融機関4行との総額7,990,000千円のシンジケートロ
ーン契約を締結いたしました。
2 【財務諸表等】
Section titled “2 【財務諸表等】”(1)【財務諸表】
Section titled “(1)【財務諸表】”① 【貸借対照表】
Section titled “① 【貸借対照表】”| (単位:千円) | |||||||||||
| 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) | ||||||||||
| 資産の部 | |||||||||||
| 流動資産 | |||||||||||
| 現金及び預金 | ※1 3,769,054 | ※1 4,015,805 | |||||||||
| 売掛金 | 108,225 | - | |||||||||
| 仕掛品 | - | 514 | |||||||||
| 前渡金 | 57,291 | 114,756 | |||||||||
| 前払費用 | 12,346 | 12,764 | |||||||||
| 関係会社短期貸付金 | - | 1,205,000 | |||||||||
| 1年内回収予定の関係会社長期貸付金 | 250,000 | - | |||||||||
| 未収消費税等 | 33,243 | 130,245 | |||||||||
| その他 | 173,147 | 3,398 | |||||||||
| 流動資産合計 | 4,403,307 | 5,482,484 | |||||||||
| 固定資産 | |||||||||||
| 有形固定資産 | |||||||||||
| 建物 | ※3 427,853 | ※3 427,853 | |||||||||
| 減価償却累計額 | △24,708 | △38,827 | |||||||||
| 建物(純額) | 403,145 | 389,026 | |||||||||
| 建物附属設備 | ※3 26,775 | ※3 33,417 | |||||||||
| 減価償却累計額 | △12,351 | △9,100 | |||||||||
| 建物附属設備(純額) | 14,423 | 24,316 | |||||||||
| 構築物 | ※3 5,583 | ※3 5,583 | |||||||||
| 減価償却累計額 | △2,363 | △3,234 | |||||||||
| 構築物(純額) | 3,220 | 2,348 | |||||||||
| 機械及び装置 | ※3 18,995 | ※3 20,023 | |||||||||
| 減価償却累計額 | △7,952 | △11,518 | |||||||||
| 機械及び装置(純額) | 11,042 | 8,505 | |||||||||
| 工具、器具及び備品 | ※3 71,872 | ※3 76,171 | |||||||||
| 減価償却累計額 | △42,969 | △61,579 | |||||||||
| 工具、器具及び備品(純額) | 28,902 | 14,592 | |||||||||
| 建設仮勘定 | 1,050 | 1,050 | |||||||||
| 有形固定資産合計 | 461,783 | 439,839 | |||||||||
| 無形固定資産 | |||||||||||
| 商標権 | 261 | 51 | |||||||||
| ソフトウエア | ※3 13,659 | ※3 13,882 | |||||||||
| その他 | 373 | 344 | |||||||||
| 無形固定資産合計 | 14,294 | 14,277 | |||||||||
| 投資その他の資産 | |||||||||||
| 投資有価証券 | 144,086 | - | |||||||||
| 関係会社株式 | 1,005,000 | 1,500,000 | |||||||||
| 長期前払費用 | 818 | 311 | |||||||||
| 敷金及び保証金 | 49,964 | 56,294 | |||||||||
| 投資その他の資産合計 | 1,199,869 | 1,556,606 | |||||||||
| 固定資産合計 | 1,675,947 | 2,010,723 | |||||||||
| 資産合計 | 6,079,255 | 7,493,207 | |||||||||
| (単位:千円) | |||||||||||
| 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) | ||||||||||
| 負債の部 | |||||||||||
| 流動負債 | |||||||||||
| 短期借入金 | - | 1,100,000 | |||||||||
| 1年内返済予定の長期借入金 | 50,000 | 75,000 | |||||||||
| 未払金 | 110,504 | 65,346 | |||||||||
| 未払費用 | 5,645 | 2,363 | |||||||||
| 未払法人税等 | 17,977 | 21,729 | |||||||||
| 前受金 | - | 11,200 | |||||||||
| 預り金 | 7,582 | 4,295 | |||||||||
| 資産除去債務 | 6,565 | - | |||||||||
| 流動負債合計 | 198,275 | 1,279,934 | |||||||||
| 固定負債 | |||||||||||
| 長期借入金 | 250,000 | 175,000 | |||||||||
| 長期預り金 | ※4 340,332 | ※4 340,332 | |||||||||
| 繰延税金負債 | 7,350 | 5,555 | |||||||||
| 資産除去債務 | 13,591 | 20,747 | |||||||||
| 固定負債合計 | 611,273 | 541,634 | |||||||||
| 負債合計 | 809,549 | 1,821,569 | |||||||||
| 純資産の部 | |||||||||||
| 株主資本 | |||||||||||
| 資本金 | 5,152,348 | 6,956,361 | |||||||||
| 資本剰余金 | |||||||||||
| 資本準備金 | 4,821,348 | 6,625,361 | |||||||||
| 資本剰余金合計 | 4,821,348 | 6,625,361 | |||||||||
| 利益剰余金 | |||||||||||
| その他利益剰余金 | |||||||||||
| 繰越利益剰余金 | △4,709,066 | △7,916,139 | |||||||||
| 利益剰余金合計 | △4,709,066 | △7,916,139 | |||||||||
| 自己株式 | - | △197 | |||||||||
| 株主資本合計 | 5,264,629 | 5,665,386 | |||||||||
| 評価・換算差額等 | |||||||||||
| その他有価証券評価差額金 | 5,075 | - | |||||||||
| 評価・換算差額等合計 | 5,075 | - | |||||||||
| 新株予約権 | - | 6,251 | |||||||||
| 純資産合計 | 5,269,705 | 5,671,638 | |||||||||
| 負債純資産合計 | 6,079,255 | 7,493,207 | |||||||||
② 【損益計算書】
Section titled “② 【損益計算書】”| (単位:千円) | |||||||||||
| 前事業年度(自 平成24年1月1日 至 平成24年12月31日) | 当事業年度(自 平成25年1月1日 至 平成25年12月31日) | ||||||||||
| 売上高 | 108,225 | 92,929 | |||||||||
| 売上原価 | 17,316 | 26,898 | |||||||||
| 売上総利益 | 90,909 | 66,030 | |||||||||
| 販売費及び一般管理費 | ※1,※2 1,482,259 | ※1,※2 3,367,522 | |||||||||
| 営業損失(△) | △1,391,350 | △3,301,492 | |||||||||
| 営業外収益 | |||||||||||
| 受取利息 | 226 | 972 | |||||||||
| 投資有価証券売却益 | - | 31,586 | |||||||||
| 受取事務手数料 | 5,641 | 9,379 | |||||||||
| 設備賃貸料 | ※3 50,324 | ※3 50,674 | |||||||||
| 助成金収入 | 36,190 | 92,077 | |||||||||
| その他 | 6,395 | 6,782 | |||||||||
| 営業外収益合計 | 98,778 | 191,472 | |||||||||
| 営業外費用 | |||||||||||
| 支払利息 | 2,769 | 15,660 | |||||||||
| 株式交付費 | 28,621 | 15,004 | |||||||||
| 為替差損 | 1,963 | 2,581 | |||||||||
| 支払手数料 | - | 35,963 | |||||||||
| 営業外費用合計 | 33,355 | 69,209 | |||||||||
| 経常損失(△) | △1,325,927 | △3,179,228 | |||||||||
| 税引前当期純損失(△) | △1,325,927 | △3,179,228 | |||||||||
| 法人税、住民税及び事業税 | 3,675 | 26,860 | |||||||||
| 法人税等調整額 | △872 | 984 | |||||||||
| 法人税等合計 | 2,802 | 27,844 | |||||||||
| 当期純損失(△) | △1,328,729 | △3,207,073 | |||||||||
【売上原価明細書】
Section titled “【売上原価明細書】”| 前事業年度(自 平成24年1月1日至 平成24年12月31日) | 当事業年度(自 平成25年1月1日至 平成25年12月31日) | ||||
| 区分 | 注記番号 | 金額(千円) | 構成比(%) | 金額(千円) | 構成比(%) |
| 経費 | ※ | 17,316 | 100.0 | 26,898 | 100.0 |
| 売上原価 | 17,316 | 100.0 | 26,898 | 100.0 | |
(脚注)
| 前事業年度(自 平成24年1月1日至 平成24年12月31日) | 当事業年度(自 平成25年1月1日至 平成25年12月31日) | ||||||||
| ※ 主な内訳は、次のとおりであります。 支払ロイヤリティ17,316千円計17,316千円 | 支払ロイヤリティ | 17,316千円 | 計 | 17,316千円 | ※ 主な内訳は、次のとおりであります。 支払ロイヤリティ11,547千円計11,547千円 | 支払ロイヤリティ | 11,547千円 | 計 | 11,547千円 |
| 支払ロイヤリティ | 17,316千円 | ||||||||
| 計 | 17,316千円 | ||||||||
| 支払ロイヤリティ | 11,547千円 | ||||||||
| 計 | 11,547千円 |
③ 【株主資本等変動計算書】
Section titled “③ 【株主資本等変動計算書】”前事業年度(自 平成24年1月1日 至 平成24年12月31日)
| (単位:千円) | ||||||
| 株主資本 | ||||||
| 資本金 | 資本剰余金 | 利益剰余金 | 株主資本合計 | |||
| 資本準備金 | 資本剰余金合計 | その他利益剰余金 | 利益剰余金合計 | |||
| 繰越利益剰余金 | ||||||
| 当期首残高 | 3,206,400 | 2,875,400 | 2,875,400 | △3,380,337 | △3,380,337 | 2,701,462 |
| 当期変動額 | ||||||
| 新株の発行 | 1,945,948 | 1,945,948 | 1,945,948 | 3,891,896 | ||
| 当期純損失(△) | △1,328,729 | △1,328,729 | △1,328,729 | |||
| 株主資本以外の項目の当期変動額(純額) | ||||||
| 当期変動額合計 | 1,945,948 | 1,945,948 | 1,945,948 | △1,328,729 | △1,328,729 | 2,563,166 |
| 当期末残高 | 5,152,348 | 4,821,348 | 4,821,348 | △4,709,066 | △4,709,066 | 5,264,629 |
| 評価・換算差額等 | 純資産合計 | ||
| その他有価証券評価差額金 | 評価・換算差額等合計 | ||
| 当期首残高 | △6,856 | △6,856 | 2,694,606 |
| 当期変動額 | |||
| 新株の発行 | 3,891,896 | ||
| 当期純損失(△) | △1,328,729 | ||
| 株主資本以外の項目の当期変動額(純額) | 11,932 | 11,932 | 11,932 |
| 当期変動額合計 | 11,932 | 11,932 | 2,575,099 |
| 当期末残高 | 5,075 | 5,075 | 5,269,705 |
当事業年度(自 平成25年1月1日 至 平成25年12月31日)
| (単位:千円) | |||||||
| 株主資本 | |||||||
| 資本金 | 資本剰余金 | 利益剰余金 | 自己株式 | 株主資本合計 | |||
| 資本準備金 | 資本剰余金合計 | その他利益剰余金 | 利益剰余金合計 | ||||
| 繰越利益剰余金 | |||||||
| 当期首残高 | 5,152,348 | 4,821,348 | 4,821,348 | △4,709,066 | △4,709,066 | ― | 5,264,629 |
| 当期変動額 | |||||||
| 新株の発行 | 1,804,013 | 1,804,013 | 1,804,013 | 3,608,027 | |||
| 当期純損失(△) | △3,207,073 | △3,207,073 | △3,207,073 | ||||
| 自己株式の取得 | △197 | △197 | |||||
| 株主資本以外の項目の当期変動額(純額) | |||||||
| 当期変動額合計 | 1,804,013 | 1,804,013 | 1,804,013 | △3,207,073 | △3,207,073 | △197 | 400,757 |
| 当期末残高 | 6,956,361 | 6,625,361 | 6,625,361 | △7,916,139 | △7,916,139 | △197 | 5,665,386 |
| 評価・換算差額等 | 新株予約権 | 純資産合計 | ||
| その他有価証券評価差額金 | 評価・換算差額等合計 | |||
| 当期首残高 | 5,075 | 5,075 | ― | 5,269,705 |
| 当期変動額 | ||||
| 新株の発行 | 3,608,027 | |||
| 当期純損失(△) | △3,207,073 | |||
| 自己株式の取得 | △197 | |||
| 株主資本以外の項目の当期変動額(純額) | △5,075 | △5,075 | 6,251 | 1,175 |
| 当期変動額合計 | △5,075 | △5,075 | 6,251 | 401,932 |
| 当期末残高 | ― | ― | 6,251 | 5,671,638 |
【注記事項】
Section titled “【注記事項】”(重要な会計方針)
Section titled “(重要な会計方針)”1. 有価証券の評価基準及び評価方法
子会社株式
移動平均法による原価法 2. たな卸資産の評価基準及び評価方法
評価基準は原価法(収益性の低下による簿価切下げの方法)によっております。
仕掛品
個別法による原価法 3. 固定資産の減価償却の方法
(1) 有形固定資産(リース資産を除く)
定率法によっております。
但し、建物(建物附属設備を除く)については定額法のよっております。
なお、主な耐用年数は以下のとおりであります。
| 建物 | 31年 |
|---|---|
| 建物附属設備 | 6~18年 |
| 構築物 | 7~10年 |
| 機械及び装置 | 2~8年 |
| 工具、器具及び備品 | 2~10年 |
(2) 無形固定資産
定額法によっております。
なお、主な耐用年数は以下のとおりであります。
| 商標権 | 10年 |
|---|---|
| 自社利用のソフトウエア | 3~5年 |
| 水道施設利用権 | 15年 |
| 4. 引当金の計上基準 |
貸倒引当金
債権の貸倒れによる損失に備えるため、一般債権については貸倒実績率により、貸倒懸念債権等特定の債権については個別に回収可能性を検討し、回収不能見込額を計上しております。なお、当事業年度においては、貸倒実績、個別の回収不能見込額がないため、貸倒引当金を計上しておりません。 5. 繰延資産の処理方法
株式交付費
支出時に全額費用として処理しております。
6. 外貨建の資産及び負債の本邦通貨への換算基準
外貨建金銭債権債務は、決算日の直物為替相場により円貨に換算し、換算差額は損益として処理しております。
7. その他財務諸表作成のための基本となる重要な事項
消費税等の会計処理
消費税及び地方消費税の会計処理は、税抜方式によっております。
(会計方針の変更)
(会計上の見積の変更と区分することが困難な会計方針の変更)
当社は、法人税法の改正に伴い、当事業年度より、平成25年1月1日以後に取得した有形固定資産について、改正
後の法人税法に基づく減価償却方法に変更しております。これによる影響は軽微であります。
(表示方法の変更)
Section titled “(表示方法の変更)”(貸借対照表関係)
前事業年度において、区分掲記しておりました流動資産の「立替金」は、金額的重要性が乏しくなったため、当事
業年度より流動資産の「その他」に含めて表示しております。この表示方法の変更を反映させるため、前事業年度の
財務諸表の組替えを行っております。
この結果、前事業年度の貸借対照表において、流動資産の「立替金」に表示していた170,195千円は、「その他」
として組み替えております。
(貸借対照表関係)
Section titled “(貸借対照表関係)”※1 担保資産及び担保付債務
担保に供している資産及び担保付債務は以下のとおりであります。
| 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) | |
|---|---|---|
| 現金及び預金 | 3,768,932千円 | 4,013,198千円 |
| 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) | |
|---|---|---|
| 子会社の1年内返済予定の長期借入金 | ―千円 | 435,000千円 |
| 子会社の長期借入金 | 7,560,000千円 | 8,700,000千円 |
| 計 | 7,560,000千円 | 9,135,000千円 |
※2 関係会社に対する資産及び負債
区分掲記されたもの以外で各科目に含まれているものは、次のとおりであります。
| 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) | |
|---|---|---|
| 立替金 | 170,100千円 | ―千円 |
※3 国庫補助金等により取得価額から控除した固定資産の圧縮記帳累計額は次のとおりであります。
| 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) | |
|---|---|---|
| 建物 | 407,235千円 | 407,235千円 |
| 建物附属設備 | 1,033,324千円 | 1,033,324千円 |
| 構築物 | 32,257千円 | 32,257千円 |
| 機械及び装置 | 941,546千円 | 941,546千円 |
| 工具、器具及び備品 | 480,124千円 | 480,124千円 |
| ソフトウエア | 2,467千円 | 2,467千円 |
※4 長期預り金
独立行政法人医薬基盤研究所より交付を受けた助成金であります。この助成金は助成対象医薬品が希少疾病用医薬品等の製造販売承認を受けた場合に、当該承認を受けた日から10年間にわたり当該医薬品等の売上高に一定割合を乗じた金額を助成金として交付された金額を限度として同研究所に対して納付金として納付する義務を負うものであります。
5 保証債務
(1) 以下の子会社について、金融機関からの借入金に対する債務保証を行っております。
| 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) | |
|---|---|---|
| 株式会社UNIGEN | 8,610,000千円 | 11,719,300千円 |
(2) 以下の子会社について、工事契約に対する債務保証を行っております。
| 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) | |
|---|---|---|
| 株式会社UNIGEN | 4,924,323千円 | ―千円 |
(3) 以下の子会社について、リース債務に対する債務保証を行っております。
| 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) | |
|---|---|---|
| 株式会社UNIGEN | 190,546千円 | 655,438千円 |
6 貸出コミットメント
当社は運転資金の効率的な調達を行うため、取引銀行と貸出コミットメント契約を締結しております。期末日に
おける貸出コミットメントに係る借入未実行残高等は、次のとおりであります。
| 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) | |
|---|---|---|
| 貸出コミットメントの総額 | ―千円 | 1,300,000千円 |
| 借入実行残高 | ―千円 | 700,000千円 |
| 差引額 | ―千円 | 600,000千円 |
(損益計算書関係)
Section titled “(損益計算書関係)”※1 販売費及び一般管理費のうち、主要な費目及び金額並びにおおよその割合は、次のとおりであります。
| 前事業年度(自 平成24年1月1日至 平成24年12月31日) | 当事業年度(自 平成25年1月1日至 平成25年12月31日) | |||
| 研究開発費 | 1,096,549 | 千円 | 2,981,080 | 千円 |
おおよその割合
販売費 0.1% 0.1%
一般管理費 99.9% 99.9%
※2 一般管理費に含まれる研究開発費
| 前事業年度(自 平成24年1月1日至 平成24年12月31日) | 当事業年度(自 平成25年1月1日至 平成25年12月31日) | |||
| 1,096,549 | 千円 | 2,981,080 | 千円 | |
※3 各科目に含まれている関係会社に対するものは、次のとおりであります。
| 前事業年度(自 平成24年1月1日至 平成24年12月31日) | 当事業年度(自 平成25年1月1日至 平成25年12月31日) | |
|---|---|---|
| 研究開発費 | 90,608千円 | 2,037,489千円 |
| 設備賃借料 | 50,324千円 | 50,324千円 |
(株主資本等変動計算書関係)
Section titled “(株主資本等変動計算書関係)”前事業年度(自 平成24年1月1日 至 平成24年12月31日)
自己株式に関する事項
該当事項はありません。
当事業年度(自 平成25年1月1日 至 平成25年12月31日)
自己株式に関する事項
| 株式の種類 | 当事業年度期首 | 増加 | 減少 | 当事業年度末 |
|---|---|---|---|---|
| 普通株式(株) | ― | 50 | ― | 50 |
(変動事由の概要)
単元未満株式買取による増加 50株
(リース取引関係)
Section titled “(リース取引関係)”該当事項はありません。
(有価証券関係)
Section titled “(有価証券関係)”前事業年度(平成24年12月31日)
子会社株式及び関連会社株式(貸借対照表計上額 関係会社株式 1,005,000千円)は、市場価格がなく、時価を把握することが極めて困難と認められることから、記載しておりません。
当事業年度(平成25年12月31日)
子会社株式及び関連会社株式(貸借対照表計上額 関係会社株式 1,500,000千円)は、市場価格がなく、時価を把握することが極めて困難と認められることから、記載しておりません。
(税効果会計関係)
Section titled “(税効果会計関係)”1. 繰延税金資産及び繰延税金負債の発生の主な原因別の内訳
| 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) | |
|---|---|---|
| 繰延税金資産(流動) | ||
| 貯蔵品 | ―千円 | 561,857千円 |
| 未払事業所税 | 286千円 | ―千円 |
| 未払事業税 | 5,403千円 | 7,135千円 |
| その他 | △12千円 | 2,219千円 |
| 小計 | 5,677千円 | 571,212千円 |
| 繰延税金資産(固定) | ||
| 繰延資産償却超過額 | 132,840千円 | 82,775千円 |
| 繰越欠損金 | 1,391,334千円 | 2,008,717千円 |
| 長期預り金 | 120,409千円 | 120,409千円 |
| その他 | 31,172千円 | 10,799千円 |
| 小計 | 1,675,757千円 | 2,222,702千円 |
| 評価性引当額 | △1,681,434千円 | △2,793,915千円 |
| 繰延税金資産の合計 | ―千円 | ―千円 |
| 繰延税金負債(固定) | ||
| 資産除去債務 | 7,350千円 | 5,555千円 |
| 小計 | 7,350千円 | 5,555千円 |
| 繰延税金負債の合計 | 7,350千円 | 5,555千円 |
2. 法定実効税率と税効果会計適用後の法人税等の負担率との差異の原因となった主な項目別の内訳
| 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) | |
| 法定実効税率 | 40.4% | 37.8% |
| (調整) | ||
| 交際費等永久に損金に | △0.1% | △0.3% |
| 算入されない項目 | ||
| 住民税均等割 | △0.3% | △0.1% |
| 評価性引当額 | △34.4% | △35.0% |
| 税率変更による影響 | △6.4% | ― |
| 外国源泉所得税 | ― | △0.8% |
| その他 | 0.6% | △2.5% |
| 税効果会計適用後の法人税等の | △0.2% | △0.9% |
| 負担率 |
(資産除去債務関係)
Section titled “(資産除去債務関係)”資産除去債務のうち貸借対照表に計上しているもの
(1) 当該資産除去債務の概要
事務所等の不動産賃貸借契約に伴う原状回復義務及び当社所有の建物に関するリサイクル費用であります。
(2) 当該資産除去債務の金額の算定方法
物件ごとに使用見込期間を見積り、対応する国債の利回りで割引いて資産除去債務の金額を計算しております。
(3) 当該資産除去債務の総額の増減
| 前事業年度(自 平成24年1月1日 至 平成24年12月31日) | 当事業年度(自 平成25年1月1日 至 平成25年12月31日) | |
|---|---|---|
| 期首残高 | 19,605千円 | 20,157千円 |
| 有形固定資産の取得に伴う増加額 | ―千円 | 6,842千円 |
| 時の経過による増減額 | 551千円 | 1,347千円 |
| 資産除去債務の履行による減少額 | ―千円 | △7,600千円 |
| 期末残高 | 20,157千円 | 20,747千円 |
(1株当たり情報)
Section titled “(1株当たり情報)”| 前事業年度(自 平成24年1月1日 至 平成24年12月31日) | 当事業年度(自 平成25年1月1日 至 平成25年12月31日) |
|---|---|
| 1株当たり純資産額 731円38銭 | 1株当たり純資産額 672円38銭 |
| 1株当たり当期純損失金額 279円87銭 | 1株当たり当期純損失金額 424円14銭 |
(注) 1. 潜在株式調整後1株当たり当期純利益金額については、潜在株式が存在するものの、1株当たり当期純損失金額を計上しているため記載しておりません。
2. 1株当たり当期純損失金額の算定上の基礎は、以下のとおりであります。
| 項目 | 前事業年度(自 平成24年1月1日 至 平成24年12月31日) | 当事業年度(自 平成25年1月1日 至 平成25年12月31日) |
| 1株当たり当期純損失金額 | ||
| 当期純損失(△)(千円) | △1,328,729 | △3,207,073 |
| 普通株式に帰属しない金額(千円) | ― | ― |
| 普通株式に係る当期純損失(△)(千円) | △1,328,729 | △3,207,073 |
| 普通株式の期中平均株式数(株) | 4,747,654 | 7,561,372 |
| 希薄化効果を有しないため、潜在株式調整後1株当たり当期純利益金額の算定に含まれなかった潜在株式の概要 | ― | |
3. 1株当たり純資産額の算定上の基礎は、以下のとおりであります。
| 項目 | 前事業年度(平成24年12月31日) | 当事業年度(平成25年12月31日) |
|---|---|---|
| 純資産の部の合計額(千円) | 5,269,705 | 5,671,638 |
| 純資産の部の合計額から控除する金額(千円) | ― | 6,251 |
| (うち新株予約権(千円)) | ― | (6,251) |
| 普通株式に係る期末の純資産額(千円) | 5,269,705 | 5,665,386 |
| 1株当たり純資産額の算定に用いられた普通株式の数(株) | 7,205,200 | 8,425,850 |
④ 【附属明細表】
Section titled “④ 【附属明細表】”【有価証券明細表】
Section titled “【有価証券明細表】”該当事項はありません。
【有形固定資産等明細表】
Section titled “【有形固定資産等明細表】”| 資産の種類 | 当期首残高(千円) | 当期増加額(千円) | 当期減少額(千円) | 当期末残高(千円) | 当期末減価償却累計額又は償却累計額(千円) | 当期償却額(千円) | 差引当期末残高(千円) |
|---|---|---|---|---|---|---|---|
| 有形固定資産 | |||||||
| 建物 | 427,853 | ― | ― | 427,853 | 38,827 | 14,119 | 389,026 |
| 建物附属設備 | 26,775 | ※118,580 | ※511,938 | 33,417 | 9,100 | 8,687 | 24,316 |
| 構築物 | 5,583 | ― | ― | 5,583 | 3,234 | 871 | 2,348 |
| 機械及び装置 | 18,995 | ※21,028 | 0 | 20,023 | 11,518 | 3,565 | 8,505 |
| 工具、器具及び備品 | 71,872 | ※34,299 | 0 | 76,171 | 61,579 | 18,609 | 14,592 |
| 建設仮勘定 | 1,050 | ― | ― | 1,050 | ― | ― | 1,050 |
| 有形固定資産計 | 552,129 | 23,908 | 11,938 | 564,099 | 124,260 | 45,852 | 439,839 |
| 無形固定資産 | |||||||
| 商標権 | 573 | ― | 317 | 256 | 204 | 210 | 51 |
| ソフトウエア | 19,632 | ※44,050 | ― | 23,682 | 9,799 | 3,826 | 13,882 |
| その他 | 440 | ― | ― | 440 | 95 | 29 | 344 |
| 無形固定資産計 | 20,645 | 4,050 | 317 | 24,378 | 10,100 | 4,066 | 14,277 |
| 長期前払費用 | 818 | 315 | 822 | 311 | ― | ― | 311 |
(注) 1. 当期増加額のうち主なものは、次のとおりであります。
※1 建物附属設備 横浜本社パーテーション工事 6,066千円
※2 機械及び装置 CIP用保管タンク攪拌機 796千円
※3 工具、器具及び備品 細胞発酵プロセス用自動分析装置 1,615千円
※4 ソフトウエア 購買管理システム 生産管理システム連携機能追加 3,000千円
2.当期減少額のうち主なものは、次のとおりであります。
※5 建物附属設備 旧横浜本社バーテーション工事 3,156千円
【引当金明細表】
Section titled “【引当金明細表】”該当事項はありません。
(2)【主な資産及び負債の内容】
Section titled “(2)【主な資産及び負債の内容】”① 現金及び預金
Section titled “① 現金及び預金”| 区分 | 金額(千円) |
|---|---|
| 現金 | ― |
| 預金 | |
| 普通預金 | 680,805 |
| 定期預金 | 3,335,000 |
| 計 | 4,015,805 |
| 合計 | 4,015,805 |
(a) 相手先別内訳
Section titled “(a) 相手先別内訳”該当事項はありません。
(b) 売掛金の発生及び回収並びに滞留状況
Section titled “(b) 売掛金の発生及び回収並びに滞留状況”| 当期首残高(千円) (A) | 当期発生高(千円) (B) | 当期回収高(千円) (C) | 当期末残高(千円) (D) | 回収率(%) (C)×100(A)+(B) | (C) | ×100 | (A)+(B) | 滞留期間(日)(A)+(D)2(B)365 | 滞留期間(日) | (A)+(D) | 2 | (B) | 365 |
| (C) | ×100 | ||||||||||||
| (A)+(B) | |||||||||||||
| 滞留期間(日) | |||||||||||||
| (A)+(D) | |||||||||||||
| 2 | |||||||||||||
| (B) | |||||||||||||
| 365 | |||||||||||||
| 108,225 | 83,967 | 192,192 | ― | 100 | 235.2 |
(注) 消費税等の会計処理は、税抜方式を採用しておりますが、上記金額には消費税等が含まれております。
③ 仕掛品
| 品名 | 金額(千円) |
|---|---|
| 受託製造品 | 514 |
| 合計 | 514 |
④ 関係会社短期貸付金
| 区分 | 金額(千円) |
|---|---|
| 株式会社UNIGEN | 1,205,000 |
| 合計 | 1,205,000 |
⑤ 関係会社株式
Section titled “⑤ 関係会社株式”| 銘柄 | 金額(千円) |
|---|---|
| (子会社株式)株式会社UNIGEN | 1,500,000 |
| 合計 | 1,500,000 |
⑥ 短期借入金
| 区分 | 金額(千円) |
|---|---|
| 株式会社三井住友銀行 | 700,000 |
| 株式会社秋田銀行 | 400,000 |
| 合計 | 1,100,000 |
(3)【その他】
Section titled “(3)【その他】”① 劣後金銭消費貸借契約修正覚書の締結
当社は、平成26年3月31日付で、株式会社UNIGENにおける一時的な費用負担に係る資金支援を目的として、株式会
社UNIGENと契約限度額を4,000,000千円とする劣後金銭消費貸借契約に係る変更覚書を締結いたしました。
② シンジケートローン契約締結に係る連帯保証
当社は、平成26年3月31日付で、株式会社UNIGENが締結する総額7,990,000千円のシンジケートローン契約に係る
連帯保証人となる契約を締結いたしました。
第6 【提出会社の株式事務の概要】
Section titled “第6 【提出会社の株式事務の概要】”| 事業年度 | 1月1日から12月31日まで |
|---|---|
| 定時株主総会 | 3月中 |
| 基準日 | 12月31日 |
| 剰余金の配当の基準日 | 6月30日12月31日 |
| 1単元の株式数 | 100株 |
| 単元未満株式の買取り | |
| 取扱場所 | 東京都千代田区丸の内一丁目4-5 三菱UFJ信託銀行株式会社 証券代行部 |
| 株主名簿管理人 | 東京都千代田区丸の内一丁目4-5 三菱UFJ信託銀行株式会社 |
| 取次所 | ― |
| 買取手数料 | 無料 |
| 公告掲載方法 | 当社の公告方法は、電子公告としております。ただし、事故その他やむを得ない事由により電子公告をすることができないときは、日本経済新聞に掲載する方法により行います。なお、電子公告は当社のホームページに掲載しており、そのアドレスは次のとおりであります。http://www.umnpharma.com/ |
| 株主に対する特典 | なし |
(注) 当社定款の定めにより、当会社の株主は、その有する単元未満株主について、次に掲げる権利以外の権利を行使できません。
(1) 会社法第189条第2項各号に掲げる権利
(2) 取得請求権付株式取得を請求する権利
(3) 募集株式又は募集新株予約権の割当を受ける権利
第7 【提出会社の参考情報】
Section titled “第7 【提出会社の参考情報】”1 【提出会社の親会社等の情報】
Section titled “1 【提出会社の親会社等の情報】”当社には、金融商品取引法第24条の7第1項に規定する親会社等はありません。
2 【その他の参考情報】
Section titled “2 【その他の参考情報】”当事業年度の開始日から有価証券報告書提出日までの間に、次の書類を提出しております。
(1) 有価証券報告書及びその添付書類及び確認書
Section titled “(1) 有価証券報告書及びその添付書類及び確認書”事業年度 第9期(自 平成24年1月1日 至 平成24年12月31日) 平成25年3月29日関東財務局長に提出。
(2) 内部統制報告書及びその添付書類
Section titled “(2) 内部統制報告書及びその添付書類”平成25年3月29日関東財務局長に提出。
(3) 四半期報告書及び確認書
第10期第1四半期(自 平成25年1月1日 至 平成25年3月31日) 平成25年5月14日関東財務局長に提出。
第10期第2四半期(自 平成25年4月1日 至 平成25年6月30日) 平成25年8月14日関東財務局長に提出。
第10期第3四半期(自 平成25年7月1日 至 平成25年9月30日) 平成25年11月14日関東財務局長に提出。
(4) 臨時報告書
企業内容等の開示に関する内閣府令第19条第2項第9号(代表取締役の異動)の規定に基づく臨時報告書 平成 25年8月6日関東財務局長に提出。
(5) 有価証券届出書及びその添付書類
第三者割当による新株式発行 平成25年9月30日関東財務局長に提出。
第三者割当による新株予約権発行 平成25年9月30日関東財務局長に提出。
第二部 【提出会社の保証会社等の情報】
Section titled “第二部 【提出会社の保証会社等の情報】”該当事項はありません。
独立監査人の監査報告書及び内部統制監査報告書
平成26年3月28日
株式会社 UMNファーマ
取締役会 御中
有限責任監査法人 トーマツ
指定有限責任社員業務執行社員 公認会計士 片 岡 久 依 印
指定有限責任社員業務執行社員 公認会計士 勢 志 元 印
<財務諸表監査>
当監査法人は、金融商品取引法第193条の2第1項の規定に基づく監査証明を行うため、「経理の状況」に掲げられている株式会社UMNファーマの平成25年1月1日から平成25年12月31日までの連結会計年度の連結財務諸表、すなわち、連結貸借対照表、連結損益計算書、連結包括利益計算書、連結株主資本等変動計算書、連結キャッシュ・フロー計算書、連結財務諸表作成のための基本となる重要な事項、その他の注記及び連結附属明細表について監査を行った。
連結財務諸表に対する経営者の責任
経営者の責任は、我が国において一般に公正妥当と認められる企業会計の基準に準拠して連結財務諸表を作成し適正に表示することにある。これには、不正又は誤謬による重要な虚偽表示のない連結財務諸表を作成し適正に表示するために経営者が必要と判断した内部統制を整備及び運用することが含まれる。
監査人の責任
当監査法人の責任は、当監査法人が実施した監査に基づいて、独立の立場から連結財務諸表に対する意見を表明することにある。当監査法人は、我が国において一般に公正妥当と認められる監査の基準に準拠して監査を行った。監査の基準は、当監査法人に連結財務諸表に重要な虚偽表示がないかどうかについて合理的な保証を得るために、監査計画を策定し、これに基づき監査を実施することを求めている。
監査においては、連結財務諸表の金額及び開示について監査証拠を入手するための手続が実施される。監査手続は、当監査法人の判断により、不正又は誤謬による連結財務諸表の重要な虚偽表示のリスクの評価に基づいて選択及び適用される。財務諸表監査の目的は、内部統制の有効性について意見表明するためのものではないが、当監査法人は、リスク評価の実施に際して、状況に応じた適切な監査手続を立案するために、連結財務諸表の作成と適正な表示に関連する内部統制を検討する。また、監査には、経営者が採用した会計方針及びその適用方法並びに経営者によって行われた見積りの評価も含め全体としての連結財務諸表の表示を検討することが含まれる。
当監査法人は、意見表明の基礎となる十分かつ適切な監査証拠を入手したと判断している。
監査意見
当監査法人は、上記の連結財務諸表が、我が国において一般に公正妥当と認められる企業会計の基準に準拠して、株式会社UMNファーマ及び連結子会社の平成25年12月31日現在の財政状態並びに同日をもって終了する連結会計年度の経営成績及びキャッシュ・フローの状況をすべての重要な点において適正に表示しているものと認める。
強調事項
重要な後発事象に関する注記に記載されているとおり、会社の子会社である株式会社UNIGENは、平成26年2月14日に経済産業省「平成23年度国内立地推進事業費補助金」の補助金額確定通知書を受領し、平成26年2月28日に補助金の交付を受けている。
当該事項は監査法人の意見に影響を及ぼすものではない。
<内部統制監査>
当監査法人は、金融商品取引法第193条の2第2項の規定に基づく監査証明を行うため、株式会社UMNファーマの平成25年12月31日現在の内部統制報告書について監査を行った。
内部統制報告書に対する経営者の責任
経営者の責任は、財務報告に係る内部統制を整備及び運用し、我が国において一般に公正妥当と認められる財務報告に係る内部統制の評価の基準に準拠して内部統制報告書を作成し適正に表示することにある。
なお、財務報告に係る内部統制により財務報告の虚偽の記載を完全には防止又は発見することができない可能性がある。
監査人の責任
当監査法人の責任は、当監査法人が実施した内部統制監査に基づいて、独立の立場から内部統制報告書に対する意見を表明することにある。当監査法人は、我が国において一般に公正妥当と認められる財務報告に係る内部統制の監査の基準に準拠して内部統制監査を行った。財務報告に係る内部統制の監査の基準は、当監査法人に内部統制報告書に重要な虚偽表示がないかどうかについて合理的な保証を得るために、監査計画を策定し、これに基づき内部統制監査を実施することを求めている。
内部統制監査においては、内部統制報告書における財務報告に係る内部統制の評価結果について監査証拠を入手するための手続が実施される。内部統制監査の監査手続は、当監査法人の判断により、財務報告の信頼性に及ぼす影響の重要性に基づいて選択及び適用される。また、内部統制監査には、財務報告に係る内部統制の評価範囲、評価手続及び評価結果について経営者が行った記載を含め、全体としての内部統制報告書の表示を検討することが含まれる。
当監査法人は、意見表明の基礎となる十分かつ適切な監査証拠を入手したと判断している。
監査意見
当監査法人は、株式会社UMNファーマが平成25年12月31日現在の財務報告に係る内部統制は有効であると表示した上記の内部統制報告書が、我が国において一般に公正妥当と認められる財務報告に係る内部統制の評価の基準に準拠して、財務報告に係る内部統制の評価結果について、すべての重要な点において適正に表示しているものと認める。
利害関係
会社と当監査法人又は業務執行社員との間には、公認会計士法の規定により記載すべき利害関係はない。
以 上
(注) 1 上記は監査報告書の原本に記載された事項を電子化したものであり、その原本は当社(有価証券報告書提出会社)が別途保管しております。2 XBRLデータは監査の対象には含まれていません。
独立監査人の監査報告書
平成26年3月28日
株式会社 UMNファーマ
取締役会 御中
有限責任監査法人 トーマツ
指定有限責任社員業務執行社員 公認会計士 片 岡 久 依 印
指定有限責任社員業務執行社員 公認会計士 勢 志 元 印
当監査法人は、金融商品取引法第193条の2第1項の規定に基づく監査証明を行うため、「経理の状況」に掲げられている株式会社UMNファーマの平成25年1月1日から平成25年12月31日までの第10期事業年度の財務諸表、すなわち、貸借対照表、損益計算書、株主資本等変動計算書、重要な会計方針、その他の注記及び附属明細表について監査を行った。
財務諸表に対する経営者の責任
経営者の責任は、我が国において一般に公正妥当と認められる企業会計の基準に準拠して財務諸表を作成し適正に表示することにある。これには、不正又は誤謬による重要な虚偽表示のない財務諸表を作成し適正に表示するために経営者が必要と判断した内部統制を整備及び運用することが含まれる。
監査人の責任
当監査法人の責任は、当監査法人が実施した監査に基づいて、独立の立場から財務諸表に対する意見を表明することにある。当監査法人は、我が国において一般に公正妥当と認められる監査の基準に準拠して監査を行った。監査の基準は、当監査法人に財務諸表に重要な虚偽表示がないかどうかについて合理的な保証を得るために、監査計画を策定し、これに基づき監査を実施することを求めている。
監査においては、財務諸表の金額及び開示について監査証拠を入手するための手続が実施される。監査手続は、当監査法人の判断により、不正又は誤謬による財務諸表の重要な虚偽表示のリスクの評価に基づいて選択及び適用される。財務諸表監査の目的は、内部統制の有効性について意見表明するためのものではないが、当監査法人は、リスク評価の実施に際して、状況に応じた適切な監査手続を立案するために、財務諸表の作成と適正な表示に関連する内部統制を検討する。また、監査には、経営者が採用した会計方針及びその適用方法並びに経営者によって行われた見積りの評価も含め全体としての財務諸表の表示を検討することが含まれる。
当監査法人は、意見表明の基礎となる十分かつ適切な監査証拠を入手したと判断している。
監査意見
当監査法人は、上記の財務諸表が、我が国において一般に公正妥当と認められる企業会計の基準に準拠して、株式会社UMNファーマの平成25年12月31日現在の財政状態及び同日をもって終了する事業年度の経営成績をすべての重要な点において適正に表示しているものと認める。
利害関係
会社と当監査法人又は業務執行社員との間には、公認会計士法の規定により記載すべき利害関係はない。
以 上
(注) 1 上記は監査報告書の原本に記載された事項を電子化したものであり、その原本は当社(有価証券報告書提出会 社)が別途保管しております。2 XBRLデータは監査の対象には含まれていません。