4588 オンコリスバイオファーマ 有価証券報告書 第10期 (2013/12期)
| 【提出書類】 | 有価証券報告書 |
| 【根拠条文】 | 金融商品取引法第24条第1項 |
| 【提出先】 | 関東財務局長 |
| 【提出日】 | 平成26年3月27日 |
| 【事業年度】 | 第10期(自 平成25年1月1日 至 平成25年12月31日) |
| 【会社名】 | オンコリスバイオファーマ株式会社 |
| 【英訳名】 | Oncolys BioPharma Inc. |
| 【代表者の役職氏名】 | 代表取締役社長 浦田 泰生 |
| 【本店の所在の場所】 | 東京都港区虎ノ門五丁目12番13号 |
| 【電話番号】 | 03-5472-1578(代表) |
| 【事務連絡者氏名】 | 管理担当取締役兼経理部長 六反田 靖 |
| 【最寄りの連絡場所】 | 東京都港区虎ノ門五丁目12番13号 |
| 【電話番号】 | 03-5472-1578(代表) |
| 【事務連絡者氏名】 | 管理担当取締役兼経理部長 六反田 靖 |
| 【縦覧に供する場所】 | 株式会社東京証券取引所 (東京都中央区日本橋兜町2番1号) |
第一部【企業情報】
Section titled “第一部【企業情報】”第1【企業の概況】
Section titled “第1【企業の概況】”1【主要な経営指標等の推移】
Section titled “1【主要な経営指標等の推移】”(1)連結経営指標等
Section titled “(1)連結経営指標等”| 回次 | 第6期 | 第7期 | 第8期 | 第9期 | 第10期 | |
| 決算年月 | 平成21年12月 | 平成22年12月 | 平成23年12月 | 平成24年12月 | 平成25年12月 | |
| 売上高 | (千円) | - | - | 185,750 | - | - |
| 経常利益(△損失) | (千円) | - | - | △74,080 | - | - |
| 当期純利益 | (千円) | - | - | 44,931 | - | - |
| 包括利益 | (千円) | - | - | 44,221 | - | - |
| 純資産額 | (千円) | - | - | 339,727 | - | - |
| 総資産額 | (千円) | - | - | 588,088 | - | - |
| 1株当たり純資産額 | (円) | - | - | 67.36 | - | - |
| 1株当たり当期純利益金額 | (円) | - | - | 8.91 | - | - |
| 潜在株式調整後1株当たり当期純利益金額 | (円) | - | - | 8.31 | - | - |
| 自己資本比率 | (%) | - | - | 57.8 | - | - |
| 自己資本利益率 | (%) | - | - | 14.1 | - | - |
| 株価収益率 | (倍) | - | - | - | - | - |
| 営業活動によるキャッシュ・フロー | (千円) | - | - | 155,126 | - | - |
| 投資活動によるキャッシュ・フロー | (千円) | - | - | △41,682 | - | - |
| 財務活動によるキャッシュ・フロー | (千円) | - | - | 168,427 | - | - |
| 現金及び現金同等物の期末残高 | (千円) | - | - | 485,929 | - | - |
| 従業員数 | (人) | - | - | 19 | - | - |
| (外、平均臨時雇用者数) | (-) | (-) | (-) | (-) | (-) | |
(注)1.当社は第8期において連結財務諸表を作成しております。第9期以降は唯一の子会社を吸収合併した事によ
り、連結財務諸表を作成しておりません。
2.売上高には、消費税等は含まれておりません。
3.第8期の株価収益率については、当社株式は非上場であるため、記載しておりません。
4. 第8期の連結財務諸表については金融商品取引法第193条の2第1項の規定に基づき、新日本有限責任監査法人により監査を受けております。
5. 第9期より、「1株当たり当期純利益に関する会計基準」(企業会計基準第2号 平成22年6月30日)、「1株
当たり当期純利益に関する会計基準の適用指針」(企業会計基準適用指針第4号 平成22年6月30日公表分)及
び「1株当たり当期純利益に関する実務上の取扱い」(実務対応報告第9号 平成22年6月30日)を適用してお
ります。
当社は平成25年3月27日付で株式1株につき100株の株式分割を行いましたが、第8期の期首に当該株式分割が
行われたと仮定し、1株当たり純資産額、1株当たり当期純利益金額及び潜在株式調整後1株当たり当期純利
益金額を算定しております。
(2)提出会社の経営指標等
Section titled “(2)提出会社の経営指標等”| 回次 | 第6期 | 第7期 | 第8期 | 第9期 | 第10期 | |
| 決算年月 | 平成21年12月 | 平成22年12月 | 平成23年12月 | 平成24年12月 | 平成25年12月 | |
| 売上高 | (千円) | 67,400 | 266,199 | 185,750 | 396,754 | 1,180 |
| 経常利益(△損失) | (千円) | △835,218 | 28,372 | △5,813 | △98,810 | △625,302 |
| 当期純利益(△損失) | (千円) | △906,799 | 37,508 | 14,989 | △102,829 | △635,553 |
| 持分法を適用した場合の投資利益 | (千円) | - | - | - | - | - |
| 資本金 | (千円) | 2,244,580 | 2,314,580 | 2,314,580 | 2,442,980 | 5,059,448 |
| 発行済株式総数 | (株) | 43,431 | 50,431 | 50,431 | 63,271 | 9,076,900 |
| (うち普通株式) | (39,795) | (46,795) | (46,795) | (59,635) | (9,076,900) | |
| (うちA種類株式) | (3,636) | (3,636) | (3,636) | (3,636) | (-) | |
| 純資産額 | (千円) | 110,099 | 295,505 | 309,785 | 472,474 | 5,093,658 |
| 総資産額 | (千円) | 378,866 | 408,391 | 556,889 | 800,366 | 5,696,651 |
| 1株当たり純資産額 | (円) | 2,535.04 | 5,859.61 | 61.43 | 74.67 | 561.17 |
| 1株当たり配当額 | (円) | - | - | - | - | - |
| (1株当たり中間配当額) | (-) | (-) | (-) | (-) | (-) | |
| 1株当たり当期純利益金額又は当期純損失金額(△) | (円) | △22,306.55 | 854.79 | 2.97 | △16.83 | △94.33 |
| 潜在株式調整後1株当たり当期純利益金額 | (円) | - | 789.38 | 2.77 | - | - |
| 自己資本比率 | (%) | 29.1 | 72.4 | 55.6 | 59.0 | 89.3 |
| 自己資本利益率 | (%) | - | 18.5 | 5.0 | - | - |
| 株価収益率 | (倍) | - | - | - | - | - |
| 配当性向 | (%) | - | - | - | - | - |
| 営業活動によるキャッシュ・フロー | (千円) | - | - | - | △151,349 | △598,528 |
| 投資活動によるキャッシュ・フロー | (千円) | - | - | - | △271,354 | 110,458 |
| 財務活動によるキャッシュ・フロー | (千円) | - | - | - | 362,451 | 5,440,081 |
| 現金及び現金同等物の期末残高 | (千円) | - | - | - | 423,855 | 5,404,610 |
| 従業員数 | (人) | 17 | 12 | 11 | 20 | 22 |
| (外、平均臨時雇用者数) | (-) | (-) | (-) | (1) | (4) | |
(注)1. 売上高には、消費税等は含まれておりません。
2. 第6期、第9期及び第10期の潜在株式調整後1株当たり当期純利益金額については、潜在株式は存在するものの、1株当たり当期純損失金額であるため記載しておりません。
4. 第6期、第9期及び第10期の自己資本利益率並びに第10期の株価収益率については、当期純損失を計上しているため記載しておりません。
5. 第6期から第9期までの株価収益率については、当社株式は非上場であるため、記載しておりません。
6. 第8期以降の財務諸表については、金融商品取引法第193条の2第1項の規定に基づき、新日本有限責任監査法人により監査を受けておりますが、第6期及び第7期の財務諸表については、監査を受けておりません。
7. 第9期より、「1株当たり当期純利益に関する会計基準」(企業会計基準第2号 平成22年6月30日)、「1株当たり当期純利益に関する会計基準の適用指針」(企業会計基準適用指針第4号 平成22年6月30日公表分)及び「1株当たり当期純利益に関する実務上の取扱い」(実務対応報告第9号 平成22年6月30日)を適用しております。
当社は平成25年3月27日付で株式1株につき100株の株式分割を行いましたが、第8期の期首に当該株式分割が行われたと仮定し、1株当たり純資産額、1株当たり当期純利益金額又は1株当たり当期純損失金額及び潜在株式調整後1株当たり当期純利益金額を算定しております。
| 年月 | 概要 |
| 平成16年3月 | 腫瘍溶解ウイルスの研究開発及び分子標的抗腫瘍薬の研究開発を目的に、「オンコリスバイオファーマ株式会社」を東京都港区に設立 |
| 平成16年12月 | 東京都港区内で本社移転 |
| 平成17年5月 | OBP-401(テロメスキャンⓇ)が、NEDO(独立行政法人新エネルギー・産業技術総合開発機構)の平成17年度「分子イメージング機器研究開発プロジェクト/悪性腫瘍等治療支援分子イメージング機器研究開発プロジェクト」の助成金に採択 |
| 平成18年3月 | 米国食品医薬品局(FDA)へOBP-301(テロメライシンⓇ)の治験申請(IND)を実施 |
| 平成18年6月 | Yale大学(米国)と新規HIV感染症治療薬の全世界における独占的ライセンス導入契約を締結し、OBP-601として研究・開発に着手 |
| 平成18年7月 | 東京都港区内で本社移転 |
| 平成18年10月 | 京都研究センターを京都府京都市に開設 |
| 平成18年10月 | OBP-301(テロメライシンⓇ)の日本国内特許成立(特許第3867968号) |
| 平成18年10月 | OBP-301(テロメライシンⓇ)のPhase I臨床試験を米国にて開始 |
| 平成19年9月 | 第5回日本バイオベンチャー大賞文部科学大臣賞受賞(主催:フジサンケイビジネスアイ) |
| 平成19年11月 | 京都研究センターを兵庫県神戸市に移転し、神戸研究センターとする |
| 平成20年3月 | Medigen Biotechnology Corp.(台湾)とOBP-301(テロメライシンⓇ)に関する戦略的提携契約を締結 |
| 平成20年3月 | 米国食品医薬品局(FDA)へOBP-601の治験申請(IND)を実施 |
| 平成20年5月 | OBP-601のPhase Ia臨床試験を米国にて開始 |
| 平成20年8月 | フランス保健製品衛生安全庁(AFSSAPS)へOBP-601のPhase Ib/IIa臨床試験の実施許可を申請 |
| 平成21年1月 | OBP-601のPhase Ib/IIa臨床試験をフランスにて開始 |
| 平成21年9月 | OBP-601の米国特許成立(米国特許第7,589,078号) |
| 平成21年10月 | アステラス製薬株式会社と新規分子標的抗癌剤の全世界における独占的ライセンス導入契約を締結し、OBP-801として研究・開発に着手 |
| 平成21年12月 | 東京都港区内で本社移転 |
| 平成22年7月 | OBP-401(テロメスキャンⓇ)が、NEDO(独立行政法人新エネルギー・産業技術総合開発機構)の平成22年度「イノベーション実用化開発費助成金」の助成金に採択 |
| 平成22年12月 | Bristol-Myers Squibb Co.(米国)とOBP-601に関するライセンス導出契約を締結 |
| 平成23年4月 | 独立行政法人医薬基盤研究所と新規検査薬OBP-1101(テロメスキャンF35)の全世界における独占的ライセンス導入契約を締結し、研究・開発に着手 |
| 平成23年6月 | OBP-401(テロメスキャンⓇ)を初めとする検査薬事業を承継させるために、新設分割によりオンコリスダイアグノスティクス株式会社を設立 |
| 平成23年10月 | Bristol-Myers Squibb Co.(米国)から第1回マイルストーンを受領 |
| 平成23年11月 | アメリカ合衆国およびカナダのLicensing Executives Societyの年次総会において、OBP-601ライセンス導出に対して産官学連携部門の平成23年度 Deals of Distinction Awardsを受賞 |
| 平成24年3月 | OBP-601のPhase IIb臨床試験がBristol-Myers Squibb Co.(米国)によって世界17ヵ国94施設で開始され、第2回マイルストーンを受領 |
| 平成24年4月 | 連結子会社であるオンコリスダイアグノスティクス株式会社を吸収合併 |
| 平成24年4月 | OBP-401(テロメスキャンⓇ)の研究目的受託検査を開始 |
| 平成24年4月 | OBP-301(テロメライシンⓇ)の米国特許成立(米国特許第8,163,892号) |
| 平成24年8月 | 順天堂大学とOBP-401(テロメスキャンⓇ)を用いた共同研究契約締結 |
| 年月 | 概要 |
| 平成24年9月 | 独立行政法人国立病院機構呉医療センター・中国がんセンターとOBP-401(テロメスキャンⓇ)を用いた共同研究契約締結 |
| 平成24年11月 | OBP-401(テロメスキャンⓇ)が、JST(独立行政法人科学技術振興機構)の研究成果最適展開支援プログラム(A-STEP)の平成24年度「フィージビリティスタディ(FS)ステージ シーズ顕在化タイプ」に採択 |
| 平成25年2月 | Geron Corporationと全世界におけるヒトテロメラーゼ逆転写遺伝子(hTERT=human Telomerase Reverse Transcriptase)プロモーターの特許について、癌に関連する検査用途での独占的な実施権の許諾に関する契約締結 |
| 平成25年5月 | OBP-801が、NEDO(独立行政法人新エネルギー・産業技術総合開発機構)の「イノベーション実用化ベンチャー支援事業」に採択 |
| 平成25年12月 | 東京証券取引所マザーズに株式を上場 |
3【事業の内容】
Section titled “3【事業の内容】”当社の事業セグメントは、「医薬品事業」と「検査薬事業」の二つです。「医薬品事業」は、医薬品の研究・開発・製造・販売を事業目的とし、「検査薬事業」は、検査薬の研究・開発・製造・販売及び検査機器の開発・製造・販売ならびに検査サービスの提供を事業目的としています。
当社は、「ウイルス」というキーワードに基づいた研究開発を行い、「癌と重症感染症」を対象に安全で有効な新薬を創出すること、及びウイルスの遺伝子改変技術を活かした新しい検査サービスを提供することで、世界中の癌・重症感染症の治療に寄与することを使命としています。
医薬品事業においては、腫瘍溶解ウイルスOBP-301(テロメライシンⓇ)やエピジェネティック癌治療薬OBP-801など医薬品候補品の開発を初期臨床試験又は外部評価が可能なステージまで進め、製薬企業にライセンスアウトし、開発進捗に応じたマイルストーン収入を得るとともに、上市後はロイヤリティ収入を得ることを基本的な事業方針としています。
検査薬事業においては、医療機関にOBP-1101(テロメスキャンF35)を用いた血中浮遊癌細胞(CTC)検査センターが開設されることを目指し、各種ウイルスによる特殊検査プラットホームビジネスを構築することを基本的な事業方針としています。
なお、医薬品事業及び検査薬事業ともにアウトソーシングを積極的に活用することで、開発期間の短縮化・開発経費の最適化を図っています。
当社の事業系統図は以下の通りです。
[事業系統図]
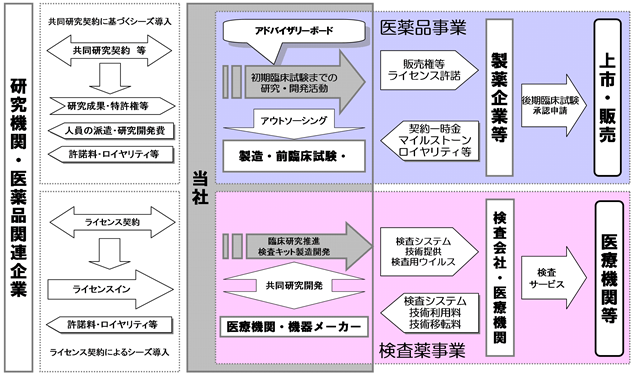
(1) 当社の収益モデルと事業領域
当社の医薬品事業は、大学等の研究機関や企業から新たな医薬品候補を導入し、当社で前臨床試験及び初期臨床試験を実施し、その製品的価値の初期評価であるProof of Concept(POC)を確認した上で、大手製薬企業・バイオ企業にライセンス許諾を行う事により、契約一時金収入・開発進捗に応じたマイルストーン収入・上市後のロイヤリティ収入を獲得する収益モデルです。
また、検査薬事業は、現在は少量の検査ウイルス販売や研究目的受託検査を行う検査サービスによる収益モデルです。しかし、将来は研究目的受託検査で蓄積したノウハウにより検体大量処理を実現させることで、検査会社や医療機関がOBP-1101(テロメスキャンF35)を用いた血中浮遊癌細胞(CTC)検査センターを開設し、当社が検査キットやユニットを検査会社や医療機関に提供する収益モデルを目指しています。
当社のウイルス研究に基づく医薬品・検査薬開発は、これまでにあまり例のない新しい技術であることから開発難度は高く、既存の製薬企業が取り組みにくい分野です。
医薬品事業において、HIV感染症治療薬OBP-601は、ライセンス先のBristol-Myers Squibb Co.(米国)主導で既に世界規模のPhaseⅡb臨床試験(用法・用量設定試験)を実施中です。また、新規の癌治療薬として開発を行っているアデノウイルス製剤OBP-301(テロメライシン®)は、既存の抗癌剤と異なり、癌局所に作用する全く新しい癌治療薬として有効性と安全性が期待され、従来の抗癌剤による副作用に悩む方々のQOL(Quality Of Life)向上に貢献できる可能性があります。エピジェネティック癌治療薬OBP-801は、癌細胞の増殖抑制や細胞死の誘導による高い有効性が期待されています。
一方、検査薬事業において、当社が開発対象とする遺伝子改変ウイルスを用いた検査薬OBP-1101(テロメスキャンF35)は、これまでのバイオマーカーでは出来なかった癌患者の予後検査(再発予測)や癌の超早期発見に寄与する可能性があります。さらに、癌組織の生検(針刺し採取)をすることなしに血中に存在する癌細胞を採取する事が可能になると考えられるため、癌遺伝子の解析がより容易となり、その後の適正な医薬品の選定に寄与する全く新しい癌検査法として期待されています。また、将来的には本技術を応用して炎症性疾患及び白血病等の領域にも拡大していくことを目指しています。
医薬品研究開発の一般的なプロセスは以下の通りです。
[医薬品研究開発の一般的なプロセス]
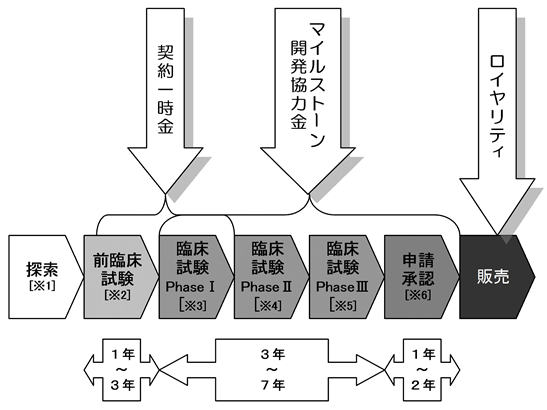
〔※1〕探索
新薬のもとになる候補化合物を探し出すプロセスです。化学物質、微生物、遺伝子などの中から、将来薬になる可能性がある新しい物質(成分)を発見し、化学的に作り出す段階です。
〔※2〕前臨床試験
基礎研究で特定された薬剤候補化合物を対象に、生物化学的試験として、動物や培養細胞を用いて安全性や有効性について調べる試験です。化学的試験として、製造方法、原薬・製剤の規格・安定性などを調べる試験です。
〔※3〕Phase I臨床試験
第1相臨床試験とも呼ばれ、治療効果を見ることを目的とせず、少数の健康な志願者を対象に、試験薬を初めてヒトに投与する試験で、主に安全性や体内における薬の分布や代謝を確認する試験です。
〔※4〕Phase II臨床試験
第2相臨床試験とも呼ばれ、限定された患者に試験薬を投与し有効性と安全性を探ることで、臨床的有用性の探索を主な目的とした試験です。探索的試験とも言われ、Phase IIa臨床試験とPhase IIb臨床試験に区分されることもあります。
〔※5〕Phase III臨床試験
第3相臨床試験とも呼ばれ、多施設にわたる多数の患者に試験薬を投与する大規模な試験で、実際に市場で用いられる場合の有効性と安全性を評価することを主目的とする試験です。検証的試験とも呼ばれ、承認申請に向けた効能・効果、用法・用量、使用上の注意等を最終的に決めることを目的とした試験です。
〔※6〕申請・承認
臨床試験で有効性や安全性などが証明された治験薬について、新薬承認申請書類を作成し、各国の規制当局に製造販売承認申請を行います。数段階の審査を受けた後に薬として承認され、市場に出ることになります。
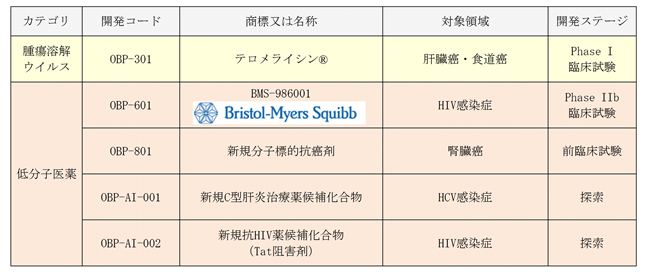
現在当社は、医薬品事業における主力パイプラインとして、
1)HIV感染症治療薬OBP-601
2)腫瘍溶解ウイルスOBP-301(テロメライシン®)
3)エピジェネティック癌治療薬OBP-801
を位置づけています。これ以外にも、
4)ウイルス感染症治療薬候補品(OBP-AI-001及びOBP-AI-002)
を保有しています。
現在までに、医薬品事業において平成22年12月にOBP-601をBristol-Myers Squibb Co.(米国)とライセンス導出契約を締結し、現在同社主導で世界規模のPhaseⅡb臨床試験が展開されています。
また、検査薬事業における主力パイプラインとして
1)血中浮遊癌細胞(CTC)検出用ウイルスOBP-1101(テロメスキャンF35)
2)炎症性疾患検出用ウイルスOBP-401(テロメスキャン®)
3)白血病検出用ウイルスOBP-1102
を保有しています。
OBP-1101(テロメスキャンF35)、OBP-401(テロメスキャン®)並びにOBP-1102の早期事業化に向けた開発を進めるとともに、OBP-1101(テロメスキャンF35)の研究目的受託検査を行っています。
今後も難治性ウイルス感染症や大企業が着手しないアンメット・メディカル・ニーズ[※1]・オーファン疾患[※2]に対象を拡大してパイプラインを充実させて参ります。
現時点における当社のパイプラインは以下の通りです。
[パイプライン開発進捗状況]

注:基礎研究:ウイルスの機能解析を行う。
臨床研究:臨床検体を用いて、実現可能性の検討を行う。
臨床性能試験:薬事申請を目標とした臨床性能試験を行う。
また、当社は基本戦略として、前臨床ならびに臨床試験に要する時間の大幅な短縮を実現するために、アウトソーシングを活用したファブレス経営〔※3〕モデルを構築し、必要人員の絶対数を削減し、統括的なプロジェクトマネジメントに特化した人財を重点的に確保・育成しています。製造・非臨床及び前臨床試験・臨床試験を積極的に外部委託していますが、外部委託に係る実施計画策定やプロトコール〔※4〕の作成と承認・最終の決定権は契約上当社が担保しています。
〔当社の収益モデルと事業領域にかかる用語解説〕
〔※1〕アンメット・メディカル・ニーズ
いまだに有効な治療法が確立されておらず、強く望まれているが、医薬品などの開発が進んでいない治療分野における医療ニーズです。
〔※2〕オーファン疾患
薬事法上対象患者が5万人以下の稀な疾患です。
〔※3〕ファブレス経営
ファブレス経営(Fabless Business)とは、自社で独自に企画・設計した製品を、他社に委託し製造する経営手法をいいます。生産設備のようなストックをできるだけ持たない手法であることからフロー型経営とも呼ばれる、製造業におけるアウトソーシングの一形態です。
〔※4〕プロトコール
プロトコール(Protocol)とは、治験実施計画書とも呼ばれます。臨床試験(治験)を実施するにあたって、その実施者(臨床試験を実施する医療機関)及び依頼者(製薬企業)が遵守しなければならない要件事項を全て網羅記載した実施計画書の事を指します。臨床試験の背景、根拠及び目的を定めるとともに、統計学的な考察も含めて、臨床試験実施のデザイン、方法及び組織について記述します。
(2) 医薬品事業について
医薬品事業における主なパイプラインは以下の通りです。
① HIV感染症治療薬OBP-601:
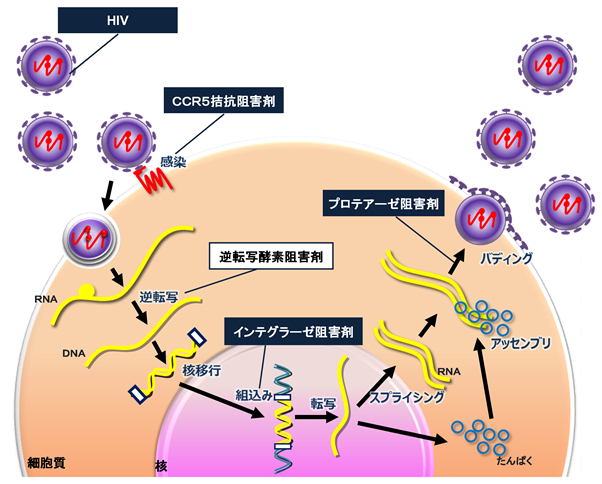
OBP-601は、HIV[*1]の複製に必須である逆転写酵素を阻害することを作用機序とする、新規のHIV感染症治療薬です。鹿児島大学附属難治ウイルス病態制御研究センターの馬場昌範教授、元昭和大学薬学部の田中博道教授、Yale大学医学部(米国)のYung-Chi Cheng教授らの共同研究により見出されたチミジン誘導体[*2]の核酸系逆転写酵素阻害剤(NRTI)[*3]です。既存のHIV感染症治療薬に耐性を持ったウイルスに対して幅広くかつ強力な抗HIV活性を示すとともに、これまでHIV感染症治療薬で問題となってきた神経障害や脂質代謝異常といった副作用が軽減される可能性があります。
当社のOBP-601は、下図の通り細胞内に侵入したHIVウイルスの持つRNAが細胞内でDNAに逆転写される時に作用する酵素の働きを阻害することで、HIVの複製の第一段階を阻害します。
<OBP-601の作用メカニズム>
a)対象疾患
OBP-601は、HIV感染症を対象疾患としています。
b)技術導入の概況
当社は、OBP-601の特許を出願・保有するYale大学(米国)との独占的ライセンス契約を平成18年6月に締結しています。
c)アライアンスの状況
当社は、平成22年12月にOBP-601の全世界における独占実施権を、Bristol-Myers Squibb Co.(米国)にライセンス導出し、契約一時金を受領いたしました。本ライセンス導出契約の締結により、今後は、OBP-601の研究・開発・販売に至る全ての費用を、ライセンス導出先であるBristol-Myers Squibb Co.(米国)が負担することになります。
また、契約一時金に加え、Bristol-Myers Squibb Co.(米国)から第1回及び第2回マイルストーン収入を受領しています。今後も、当社は開発の進捗に応じて段階的にマイルストーン収入を獲得致します。さらに、当パイプラインの承認・上市後は、販売実績に応じたロイヤリティ収入と、一定金額の販売達成時のマイルストーン収入を獲得することとなります。
ロイヤリティ収入を除く、ライセンス契約による当社の収入総額は、最大で2億8,600万ドルとなる見通しです。
d)研究開発の概況
OBP-601は、平成20年5月より米国において健康成人男子を被験者とするPhase Ia臨床試験を実施し、さらに同年11月より、フランス国内の6施設においてHIV感染症患者32例に対して安全性と有効性を検討するPhase Ib/IIa臨床試験を実施し、予定通り完了いたしました。
上記臨床試験の結果から、
1)臨床的に問題となる副作用は認められませんでした。
2)経口投与後に本剤は速やかに吸収され、その後全身に分布し、その80%が未変化体として48時間以内に尿中に排出されることが判明しました。また、これらの試験で薬動力学的評価を行った結果、HIVの増殖を一定値以上阻害するために必要なOBP-601の投与量が、動物試験等で求められた最大無毒性量(No Observed Adverse Effect Level, NOAEL=毎日摂取(曝露)しても副作用などの悪い影響が出ない最大投与量)である100mg/kg(体重60kgの人に対して6g)を理論上大きく下回り、安全な投与量で十分な効果が得られる可能性を強く示唆しました。
3)OBP-601は、リンパ球内で三リン酸体に変化することで活性型となりHIVの増殖を阻害しますが、この三リン酸体が長時間にわたりリンパ球内で一定以上の濃度を保つ結果が得られました。すなわち本剤が尿中に排出された後も、リンパ球内に残存する活性型により長時間効果が持続することが判明しました。
- 本剤は臨床において1日1回100~600㎎を経口投与することが予測されました。
さらに、前臨床試験の結果から、OBP-601は既存のHIV感染症治療薬に対する耐性ウイルスのほぼ全てに対して強力な抗ウイルス活性を示すことが確認され、更に世界各地に存在するHIVウイルスの亜種に対しても同様に強力な抗ウイルス活性を示しており、既存のHIV感染症治療薬に比べ優れた効果が期待できると判断されました。
Bristol-Myers Squibb Co.(米国)とのライセンス契約締結により、同社主導にて17か国94施設での世界同時治験のネットワークを用いてOBP-601のPhase IIb臨床試験が進行中です。当社はBristol-Myers Squibb Co.(米国)より定期的な進捗報告を受けるほか、随時開発進捗をチェックしています。
e)製造体制
当社では、OBP-601の自社製造を行っておりません。また、Bristol-Myers Squibb Co.(米国)とのライセンス契約締結により、今後は、同社主導にて製造を行っていきます。
f)販売体制
Bristol-Myers Squibb Co.(米国)とのライセンス契約締結により、承認・上市後は同社にて販売を行っていきます。
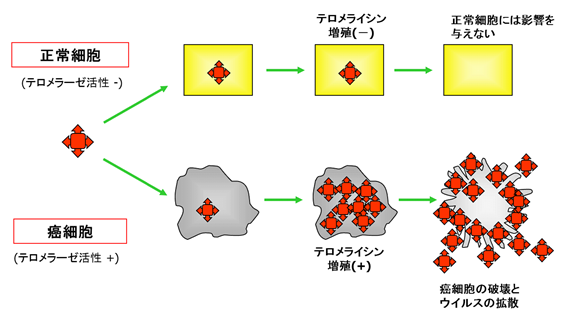
② 腫瘍溶解ウイルスOBP-301(テロメライシンⓇ):
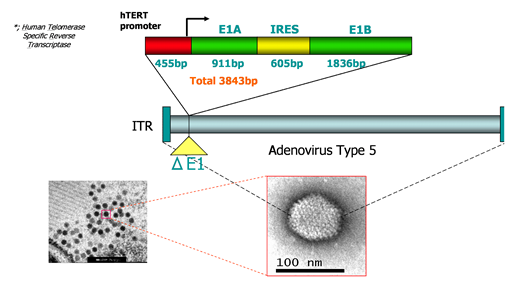
OBP-301(テロメライシンⓇ)はアデノウイルス[*4]を遺伝子改変した製剤であり、その遺伝子配列の先端にヒトテロメラーゼ逆転写酵素(hTERT = human Telomerase Reverse Transcriptase)[*5]のプロモーター[*6]配列を導入することで、癌細胞特異的に増殖し、癌細胞を溶解させるメカニズムを有しています。
5型のアデノウイルスは自然界にも存在し、ヒトに扁桃腺炎を発症させることがありますが、人体への致死的な影響は極めて低いことが医学的に認められています。また、5型のアデノウイルスは、遺伝子治療用ベクター(遺伝子搬送体)としてこれまで数多く臨床試験で用いられており、その安全性は既に多くの臨床試験で確認されています。
テロメラーゼは、主に癌細胞で特異的に発現していることが明らかになっており、癌細胞がその高い増殖能力を維持するメカニズムの一つとして認識されています。
OBP-301(テロメライシンⓇ)は、テロメラーゼ活性の高い癌細胞において特異的に増殖することで癌細胞を溶解させる強い抗腫瘍活性を示し、正常細胞中での増殖能力は極めて低いことにより、臨床的な安全性を保つことが期待されています。また、放射線治療や化学療法剤との併用により、更に強力な抗腫瘍活性が導き出せる可能性が報告されています。
OBP-301(テロメライシンⓇ)は、手術療法・放射線療法に続く第3の癌局所療法として臨床現場で有用されることを目指しています。
a)対象疾患
肝臓癌や食道癌などの固形癌を対象にします。
b)技術導入の概況
当社は、OBP-301(テロメライシンⓇ)の開発にあたって、TLO法〔*7〕に基づく知的財産管理機関である関西ティー・エル・オー株式会社から、「特許権又は特許を受ける権利」を正当に譲り受け、事業化が推進できる体制を築いています。
その結果、OBP-301(テロメライシンⓇ)は、平成18年10月に日本国内の特許(特許第3867968号)を、平成24年4月に米国における特許(米国特許第8,163,892号)を取得しています。本書提出日時点において、以下の海外主要諸国においても特許取得もしくは出願中です。日本の特許は、当社と関西ティー・エル・オー株式会社の共有、海外指定国における特許及び特許出願は当社単独で保有しています。
| 特許取得済みの国 | 日本・米国・南アフリカ・シンガポール・ニュージーランド・オーストラリア・中国・香港・韓国・カナダ |
| 特許出願中の国 | 欧州 |
OBP-301(テロメライシンⓇ)は、関西ティー・エル・オー株式会社より「特許権又は特許を受ける権利」を正当に譲り受け、事業化が推進できる体制を築いていますが、一部の要素について他社が保有する特許に関連しています。そのため、当該他社特許期間の満了前に製造販売承認を受け、製造販売を開始する場合には、当該他社特許のライセンス導入を受ける必要があります。また、当該他社特許期間の満了前にOBP-301(テロメライシンⓇ)を他社にライセンス導出する場合には、当該他社特許のライセンスを受ける必要性を、ライセンス導出先が考慮することになります。
当社は、必要に応じて当該他社特許のライセンス導入に努めてまいりますが、万一、適時に当該他社特許のライセンスを受けることができない場合には、当該他社特許の満了時期まで製造販売を開始する時期やライセンス導出する時期を遅らせなければならない可能性があります。
しかしながら、OBP-301(テロメライシンⓇ)は、現在の臨床開発計画上、順調に開発が進んだとしても、製造販売承認を受ける時期は当該他社特許期間の満了以降です。また、当社は、本書提出日時点において、当該他社特許権者との間での苦情及び訴訟等といった問題は認識しておりません。
そのため、当社独自で製造承認取得まで開発する場合、OBP-301(テロメライシンⓇ)を他社へライセンス導出する場合のいずれであっても、事業自体の継続に大きな支障をきたすものではないと考えています。
c)アライアンスの状況
平成20年3月にMedigen Biotechnology Corp.(台湾)と戦略的アライアンス契約を締結致しました。現在同社とともに、韓国及び台湾での肝臓癌を対象としたPhase I/Ⅱ臨床試験の準備を進め、早期にPOCを確認し、大手製薬企業へのライセンスを目論んでいます。
d)研究開発の概況
当社がこれまでに実施した前臨床試験では、様々な癌細胞に対して優れた抗腫瘍効果を示し、毒性試験並びに生物学的分布試験においても安全性上問題となるような所見を示しませんでした。その結果、平成18年8月にFDA(米国食品医薬品局)/CBER(生物医薬品局)から各種固形癌患者を対象としたPhase I臨床試験実施の許可を得、米国において単回投与16例及び反復投与6例の試験を完了致しました。その結果、高度な副作用は認められず、一部患者での腫瘍縮小効果が認められました。
国内では、岡山大学における食道癌及び頭頸部癌を対象とした放射線との併用療法に関する臨床研究について、平成24年8月に厚生労働省より実施承認を得て、平成25年11月に食道癌患者に対して第一例目の投与を行っています。
また、OBP-301(テロメライシンⓇ)は、アジア圏で著しく増えている肝臓癌を対象とする開発に関して、既にPhaseⅠ/Ⅱ臨床試験のプロトコールがFDAより認められています。今後は平成20年3月に戦略的アライアンス契約を締結したMedigen Biotechnology Corp.(台湾)と共に韓国・台湾での臨床試験を開始し、早期のPOCの確認を目指しています。
e)製造体制
当社は、OBP-301(テロメライシンⓇ)について自社でGMP〔*8〕製造を行わず、Lonza Houston, Inc.(米国)に定期的な品質試験の実施と共に、今後の製造を委託しています。
f)販売体制
当社は、OBP-301(テロメライシンⓇ)に関して、開発権及び販売権の許諾を目指す活動を行っています。現在は、当社が想定する将来のアライアンス候補先である製薬企業やバイオ企業に対して、OBP-301(テロメライシンⓇ)の研究開発進捗状況を随時情報提供しライセンス交渉の機会を作っています。
しかしながら、ウイルス製剤であるOBP-301(テロメライシンⓇ)は、特に日本において特殊なデリバリー体制構築が必要な可能性があります。日本国内の販売につきましては、ライセンス導出先の流通体制支援や国内販売体制の構築など、OBP-301(テロメライシンⓇ)の流通スキームの支援を行う可能性があります。
<OBP-301(テロメライシンⓇ)の構造>
OBP-301(テロメライシンⓇ)は、ヒトテロメラーゼ逆転写酵素(hTERT)遺伝子プロモーターをアデノウイルス5型のE1領域〔*9〕に組み込み、更に同領域にIRES配列〔*10〕を導入することによって癌細胞内での複製効率を高めた制限増殖型の腫瘍溶解ウイルスです。
OBP-301(テロメライシンⓇ)のDNA構造は以下の通りです。
③ エピジェネティック〔*11〕癌治療薬OBP-801
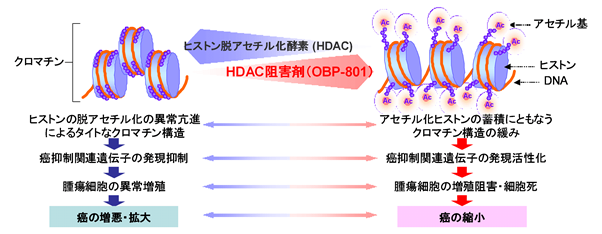
OBP-801は分子標的抗癌剤[*12]であり、癌のエピジェネティック治療薬の一つであるヒストン脱アセチル化酵素(Histone Deacetylase; HDAC)阻害剤です。
近年のエピジェネティック研究により、染色体のアセチル化やDNAメチル化などの後天的な遺伝子修飾異常が発癌機構に強く関与していることが明らかとなり、癌治療の新規標的として注目されています。
HDACは、染色体構成タンパク質であるヒストンを脱アセチル化することで染色体構造を緊密にし、遺伝子の発現を抑制します。多くの癌細胞では、このHDACが異常活性化することによって癌抑制遺伝子の発現が抑制され、無制限な異常増殖が起こり、細胞が癌化すると考えられています。
OBP-801は、HDACの活性を特異的かつ強力に阻害することで、癌細胞におけるアポトーシス[*13]関連遺伝子などの癌抑制遺伝子の発現を促し、癌細胞の増殖抑制や細胞死を誘導するなどの抗腫瘍効果を示すことが期待されています。
HDAC阻害剤は、Merck社(米国)のZolinza®(vorinostat)が平成18年(日本では平成23年)に、またCelgene社(米国)のIstodax®(romidepsin)が平成21年にそれぞれT細胞リンパ腫を対象として、欧米で承認・上市されており、既にPOCが確認されてます。
OBP-801は、これまでの検討において、Zolinza®及びIstodax®を含む既存のHDAC阻害剤と比較して極めて強いHDAC阻害活性を示し、幅広い癌腫に対する効果が期待されます。
a)対象疾患
OBP-801は、再発性腎臓癌を対象疾患としています。
b)技術導入の概況
当社は、平成21年10月にアステラス製薬株式会社よりOBP-801に関する独占実施権を獲得しています。
c)アライアンスの状況
早期にPOCを確認し、国内外の大手製薬企業等へのライセンスを行うべく、現在活動を続けています。
d)研究開発の概況
導入元のアステラス製薬株式会社において、既にほとんどの前臨床試験が終了し、且つGMP原薬製造が完了している状態です。現在、追加前臨床試験を実施中であり、早期の治験申請(IND)を目指しています。
e)製造体制
当社は、OBP-801について自社でGMP製造を行っておらず、臨床試験中に、次回GMP製造の委託先を選定する必要があります。
f)販売体制
大手製薬企業等へのライセンス後、ライセンス導出先が販売を行います。
④ その他医薬品事業
新規感染症治療薬 OBP-AI-001/002
鹿児島大学附属難治ウイルス病態制御研究センターとの共同研究契約の成果として、新規C型肝炎治療候補化合物OBP-AI-001及び新規メカニズムのHIV治療候補化合物OBP-AI-002が見出されました。
C型肝炎感染症患者はアジア地域に多く、慢性肝炎・肝硬変を経て肝臓癌へ進行します。世界保健機構(WHO)によると、アジア地域には約60万人、日本には約4万人の肝臓癌患者がいると報告されています。当社は、C型肝炎感染症の新規治療薬開発を推進することで、十分な治療法が確立されていない肝臓癌の発生抑制に貢献したいと考えています。
OBP-AI-001は、活性のメカニズムを明らかにすることで更に高活性化合物を創製し、適確に前臨床試験に進める計画です。
HIV感染症は、HAART(Highly Active Anti-Retroviral Therapy)と呼ばれる複数の薬剤を組み合わせる治療方法が一般的となり、コントロール可能な慢性疾患となっています。しかし、感染細胞に組み込まれたウイルス遺伝子を除去することができず、薬剤の長期服用が必要となるため、薬剤耐性ウイルスの出現が問題となっており、新規な作用機序を有する抗ウイルス薬の開発が求められています。
OBP-AI-002は、合成展開を完了することで、最適化合物を用いた前臨床試験への適確な移行を目指しています。
(3)検査薬事業について
検査薬事業については、以下の3種類のウイルスによる検査プラットホームを構成しています。
OBP-1101(テロメスキャンF35)の構造模式図
OBP-401(テロメスキャンⓇ)の構造模式図
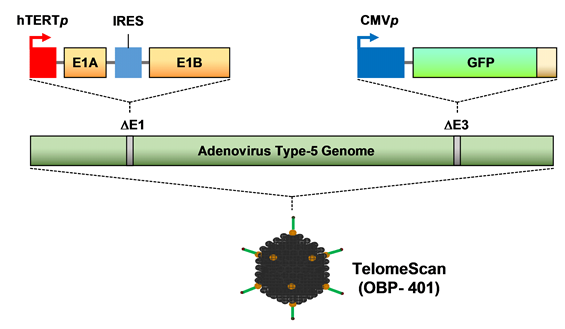
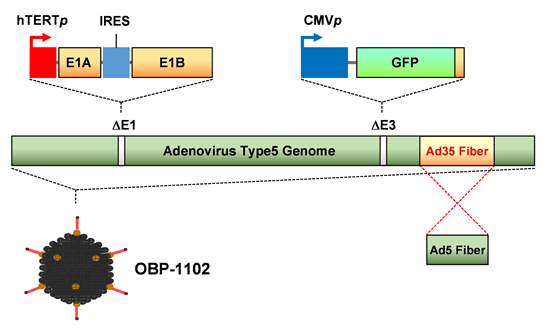
OBP-1102の構造模式図
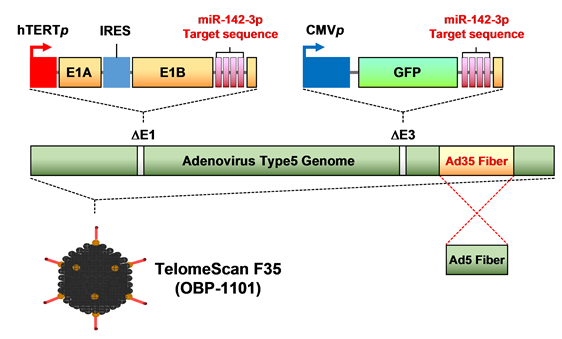
A) OBP-1101(テロメスキャンF35)は、OBP-301(テロメライシンⓇ)のウイルス遺伝子配列中のE3領域〔*14〕にオワンクラゲの緑色蛍光蛋白質(GFP)〔*15〕遺伝子を組み込み、更に35型のアデノウイルスのウイルスファイバーとマイクロRNA標的配列を導入し、感染率向上と癌特異性を高めた新規癌検査用遺伝子改変ウイルスです。
B) OBP-401(テロメスキャンⓇ)は、OBP-301(テロメライシンⓇ)のウイルス遺伝子配列中のE3領域にGFP遺伝子を組み込み、炎症性細胞などのテロメラーゼ陽性細胞で特異的に蛍光発光を促す遺伝子改変ウイルスです。
C) OBP-1102は、OBP-1101(テロメスキャンF35)の基本構造を持ったウイルス遺伝子配列からマイクロRNA標的配列を除去し、白血病細胞で特異的な蛍光発光を促す遺伝子改変ウイルスです。
これらのウイルスの特長を生かし、OBP-1101(テロメスキャンF35)を用いた血中浮遊癌細胞(CTC)検査、OBP-401(テロメスキャンⓇ)を用いた炎症性疾患(クローン病、潰瘍性大腸炎など)検査及びOBP-1102を用いた白血病の化学療法剤による完全寛解の高感度判定検査を、当社の体外検査事業プラットホームに据え、早期事業化を目論んでいます。
a)対象疾患
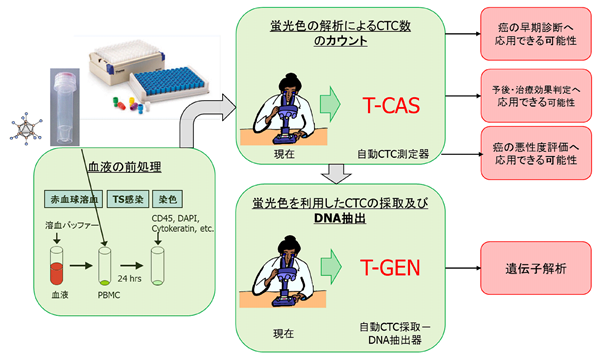
OBP-1101(テロメスキャンF35)は、これまでの技術では検出が困難であったCTC検出を可能とし、幅広い癌種での体外検査による予後予測・超早期検査などへの応用を目指し、開発を進めています。特に、既存技術では効率的に検出できなかった肺癌や、今後罹患数の増加が予測される前立腺癌や乳癌のCTCに焦点を当て、血液中のCTCの個数ばかりではなく、悪性度の評価をするサービス(T-CAS)を行い、癌患者の予後予測や治療法の選択を可能にすることが期待されています。更にCTCを用いた遺伝子解析サービス(T-GEN)を可能とし、危険を伴う癌の組織生検を行うことなく、癌患者に適した抗癌剤の選択を容易にすると期待されています。
OBP-401(テロメスキャンⓇ)は全身性炎症疾患検査の可能性が期待されています。また、体内検査薬として、OBP-401(テロメスキャンⓇ)を手術前の癌組織に注射することによって、原発巣及び転移リンパ節を蛍光発光させ、目的とする部位だけを手術によって摘除し、臓器をできるだけ温存させる手術(ナビゲーション手術)〔*16〕を可能にさせる技術に応用していきたいと考えています。
OBP-1102は、血中の微量な白血病細胞の検出可能性を検討しています。ウイルスの最適化後に、白血病患者の化学療法後の完全寛解の判断を可能とさせる事が期待されています。
b)技術導入の概況
OBP-1101(テロメスキャンF35)及びOBP-1102は、創製元の医薬基盤研究所より平成23年4月28日付で世界における独占実施権を獲得しています。
OBP-401(テロメスキャンⓇ)は、OBP-301(テロメライシンⓇ)と同様に発明者及び関西ティー・エル・オー株式会社から、平成17年3月31日付で「特許を受ける権利」や「特許権」を正当に譲り受け、事業化が推進できる体制を築いています。現在、国内外において特許出願中です。
また、平成25年2月15日付で、当社は、Geron Corporationと全世界におけるヒトテロメラーゼ逆転写酵素(hTERT)遺伝子プロモーターの特許について、OBP-1101(テロメスキャンF35)、OBP-401(テロメスキャンⓇ)、OBP-1102の癌に関連する検査用途での独占的な実施権の許諾に関する契約を締結しています。
c)アライアンスの状況
当社は、体外検査薬としての開発及びライセンス活動を優先的に行っています。研究目的受託検査で蓄積したノウハウにより検体大量処理を実現させ、検査会社や医療機関がOBP-1101(テロメスキャンF35)を用いた血中浮遊癌細胞(CTC)検査センターを開設し、当社が検査キットやユニットを検査会社や医療機関に提供するビジネスモデルを想定しています。
体内検査薬としてのアライアンスに関しては、毒性試験実施等の技術的な課題をクリアすることを優先しており、現在のところ活動を行っておりません。
d)研究開発の概況
当社は以下の3種類の臨床検査用ウイルスを開発しています。従来の臨床検査では容易ではない新しい癌や炎症性疾患の検査方法を創製していくことを目的として、ウイルスを用いた臨床検査プラットホームを形成していきたいと考えています。
i) OBP-1101(テロメスキャンF35)
OBP-1101(テロメスキャンF35)は、癌細胞での増殖特異性を高め、血中浮遊癌細胞(CTC)検出感度や特異度でOBP-401(テロメスキャンⓇ)よりも良好な結果を得ることができました。現在、これまでCTCの検出が困難とされてきた肺癌をはじめ前立腺癌、乳癌あるいは消化器癌を対象として、医療機関と臨床研究を実施しています。
ii) OBP-401(テロメスキャンⓇ)
当社はOBP-401(テロメスキャンⓇ)を、難易度の高かった血中浮遊癌細胞(CTC)検出に応用すべく研究開発を進め、様々な癌患者の血液中のCTC検出を可能にしてきましたが、平成25年8月に更に癌細胞への特異性の高いOBP-1101(テロメスキャンF35)に研究開発をシフトさせることとしました。現在、OBP-401(テロメスキャンⓇ)は各種炎症性疾患の検査用として、血液中の活性化された炎症性細胞の検出を目的として開発を進めています。
iii) OBP-1102
OBP-1102は、白血病細胞に感染して蛍光発光させることが期待されています。白血病の治療には化学療法剤が用いられ完全寛解が成されますが、骨髄に残存した癌組織の有無によってその再発率は大きく異なってきます。ウイルスの最適化を実施した上で、血液中の残存白血病細胞検出を目的として、OBP-1102の研究開発を行っています。
e)製造体制
当社は、これまで兵庫県神戸市に神戸検査センターを開設し、自社製造体制の構築を目指していますが、必要に応じて外部へ製造を委託する予定です。
f)販売体制
当面の活動は、OBP-1101(テロメスキャンF35)を用いた自由診療の範囲での研究目的受託検査が主体となります。その後、研究目的受託検査で蓄積したノウハウにより検体大量処理を実現させ、検査会社や医療機関がOBP-1101(テロメスキャンF35)を用いた血中浮遊癌細胞(CTC)検査センターを開設し、当社が検査キットやユニットを検査会社や医療機関に提供していきます。同様の事業展開をOBP-401(テロメスキャンⓇ)及びOBP-1102でも検討しています。
各ウイルスを用いた検査は非常に専門性が高く、癌、アレルギー・炎症性疾患及び白血病の基幹病院やクリニックが対象になると考えられます。
〔医薬品事業及び検査薬事業にかかる用語解説〕
〔*1〕HIV
HIV(ヒト免疫不全ウイルス=Human Immunodeficiency Virus)は、人の免疫細胞に感染し免疫細胞を破壊して、後天的に免疫不全を発症させるウイルスです。俗称的に「エイズウイルス」と呼ばれることがありますが、正式な名称ではありません。
〔*2〕チミジン誘導体
デオキシリボ核酸 (DNA) を構成する塩基の1つであるチミン (thymine)と、同じくDNAを構成する糖であるデオキシリボースが結合したデオキシヌクレオシドをチミジン(thymidine)といいます。チミジンは細胞に取り込まれるとリン酸化されてヌクレオチドになり、DNA に取り込まれます。誘導体とは、ある有機化合物を母体として、官能基の導入、酸化、還元、原子の置き換えなど、母体の構造や性質を大幅に変えない程度の改変がなされた化合物のことです。
〔*3〕核酸系逆転写酵素阻害剤(NRTI)
逆転写酵素阻害剤は逆転写酵素の働きを阻害する薬であり、ウイルス遺伝子から宿主細胞核に組み込まれるDNA へのコピーをできなくさせます。
逆転写酵素阻害剤は2 種類に分けられます。
核酸 (ヌクレオシド)系逆転写酵素阻害剤は、核酸というDNAの部品と構造的に類似したまがいものであるため、正しいHIV のプロウイルスDNA ができなくなります。
非核酸 (非ヌクレオシド)系逆転写酵素阻害剤は逆転写酵素そのものに結びつき、その形を壊し、酵素の働きを失わせることにより、HIV のDNA 複製を阻害します。
〔*4〕アデノウイルス
アデノウイルスは、正二十面体構造の二本鎖DNAウイルスで、ヒトの場合は気道に感染し、のどの腫れなどのいわゆる風邪の症状を起こします。アデノウイルスには、1型から51型まで51の血清型があり、ヒトアデノウイルス5型は小児の上気道感染症の原因となるウイルスで、36 kbの2本鎖直線状のDNAゲノムを有しています。組換えDNA実験ではアデノウイルス5型がよく使われます。この属のウイルスは深刻な疾患の原因とはならず、サイズの大きな遺伝子を組み込むことができることから、遺伝子治療に応用されてきました。
〔*5〕ヒトテロメラーゼ逆転写酵素(hTERT=human Telomerase Reverse Transcriptase)
テロメラーゼは、テロメアの伸長を行う酵素であり、RNAからDNAを合成するポリメラーゼの一種です。RNAから情報をDNAに移す酵素を逆転写酵素と呼びます。逆転写酵素が発見される以前は、細胞内での遺伝情報の流れは、DNAの情報がRNAに転写され、RNAの情報がタンパク質に翻訳される一方向のみであると考えられていました。その後、特定のウイルス(レトロウイルス)からRNAを鋳型としたDNAへの転写機構が発見され、RNAからDNAへ逆に流れるというところから、逆転写という名称がつけられました。
hTERTは、ヒトテロメラーゼ複合体の構成要素として働く酵素タンパク質で、RNAの塩基配列を写しとって DNA を合成する反応を行う酵素であり、不死化細胞及び90%近くのヒトの癌細胞中で活性が増強します。
〔*6〕プロモーター
メッセンジャーRNA合成(DNAからRNAを合成する段階;転写)の開始に関与するDNA上の特定領域の短い塩基配列です。ここにRNAポリメラーゼ(RNAを合成する酵素)が結合し、転写が開始されます。
プロモーター領域は、その遺伝子が器官・組織のどの部分で、どのような時に発現するかという重要な情報を持っており、RNA合成のスイッチとして働きます。癌細胞のみでテロメラーゼ活性が高いことは、hTERTプロモーターが癌細胞で特異的に働いていることを示しています。この性質を利用してhTERTプロモーターを組み込んだOBP-301(テロメライシンⓇ)は、腫瘍細胞特異的に増殖します。
〔*7〕TLO法
正式には「大学等における技術に関する研究成果の民間事業者への移転の促進に関する法律(平成10年5月6日法律第52号)」といい、産業活性化・学術進展のため、大学の技術や研究成果を民間企業へ移転する仲介役となる承認TLO(技術移転機関)の活動を国が支援するための法律です。
〔*8〕GMP
Good Manufacturing Practiceの略称で、品質の良い医薬品・医療用具などの製造時の管理・遵守事項を定めたものを指します。昭和37年に米国の「食品、薬品、化粧品法」の中に「薬品の製造規範(GMP)に関する事項」が取り入れられ、その後、世界保健機構(WHO)が創案したWHOGMPを昭和44年の同総会で加盟各国が採択したことにより、医薬品における国際貿易ではGMPに基づく証明制度が採用されました。日本のGMPは厚生労働省薬事法の内、医薬品の研究、開発、教育訓練、製造設備、原料、製造、中間体、最終製品、廃棄物、包装資材、検査、販売、不合格品及び回収品等について規定し、それを記録、文書化する事を義務付けた省令です。
〔*9〕E1領域
ヒトアデノウイルスゲノムは、5’逆方向末端反復配列(ITR)、パッケージングシグナル(ψ)、初期遺伝子領域E1A及びE1BからなるE1、E2、E3、E4、後期遺伝子領域L1~L5、及び3’ITRを含みます。E1及びE4は調節タンパク質を含み、E2は複製に必要なタンパク質をコードし、L領域はウイルスの構造タンパク質をコードします。E1A及びE1B遺伝子は、ウイルスの増殖に必須な初期遺伝子です。
〔*10〕IRES配列
IRES(Internal Ribosome Entry Site)と呼ばれる遺伝子配列は、一本のメッセンジャーRNAの途中から翻訳を開始させることができる配列です。このため複数の遺伝子を含むベクターに組み込んで使われています。
〔*11〕エピジェネティック
DNA配列の変異や欠失・置換等の遺伝子そのものの構造的な変化を伴わず、DNAのメチル化や染色体タンパク質ヒストンのアセチル化など、遺伝子構造の後天的な修飾により発現調節がなされることを、遺伝子のエピジェネティックな変化と呼びます。この遺伝子のエピジェネティックな変化に作用することで効果を発揮する薬をエピジェネティック治療薬と呼びます。
〔*12〕分子標的抗癌剤
癌細胞の増殖や転移に特異的に、あるいは癌細胞で多く発現している異常なタンパクや酵素を標的とする抗癌剤。従来の化学療法は癌細胞を殺す作用(殺細胞)によって治療効果を発揮するだけでなく、正常細胞にも障害を与えることで副作用を引き起こすのに対し、分子標的抗癌剤は癌細胞特異的に癌の増殖や転移を抑えることで副作用の軽減にも繋がることが期待されています。
〔*13〕アポトーシス
細胞の死に方の1種。多細胞生物の細胞における増殖制御機構として管理・調節された、能動的な細胞死です。発生の過程や老化などの生物現象に、アポトーシスはなくてはならないものであり、癌の発生のみならず、神経変性疾患や自己免疫疾患の発症などにも重要な役割を果たしています。
〔*14〕E3領域
E3領域はアデノウイルスの初期遺伝子群のうちのひとつで、培養細胞での増殖にはかならずしも必須でないことが知られています。そのため、さまざまな遺伝子のベクター(運び屋)としてアデノウイルスを利用する場合に、このE3領域が目的遺伝子の組み込みに多く用いられています。
〔*15〕緑色蛍光発光蛋白質(GFP)
Green Fluorescent Protein(GFP)は、オワンクラゲが持つ緑色蛍光発光蛋白質です。1960年代に米国ボストン大学の下村脩教授によって発見され、下村博士はこの発見の功績によって平成20年ノーベル化学賞を受賞しました。
〔*16〕ナビゲーション手術
ナビゲーション手術とは、手術中に手術器具や人工関節が骨のどの位置にあるか、また計画通りに手術をするためにはあとどの方向へどれくらい進めばいいかなどの情報を随時モニターに表示してくれるシステムを利用した手術を指します。
4【関係会社の状況】
Section titled “4【関係会社の状況】”| 名称 | 住所 | 資本金 | 主要な事業 の内容 | 議決権の所有割合(又は被所有)割合(%) | 関係内容 |
| (その他の関係会社) WONIK CUBE Corp. (注)1 | 大韓民国京畿道城南市盆唐区 | 101.9 億ウォン | 化学流通 | (7.85) | - |
| HUNUS BIO Inc. (注)2 | 大韓民国ソウル広津区 | 25.5 億ウォン | 医療用化粧品 製造販売 | - | 医薬品及び検査薬の共同開発等 |
(注) 1.WONIK CUBE Corp.は韓国KOSDAQ上場会社であります。同社は平成25年8月23日付で、HUNUS Inc.から社名変更しております。また、同社は平成25年7月4日及び平成25年7月5日付で、保有する当社株式80万株を譲渡したため、その他の関係会社に該当しないこととなりました。
2.HUNUS BIO Inc.は平成24年12月31日付で所有する全株式を譲渡し、平成25年6月14日付で行われた名義書換を
もって、その他の関係会社に該当しないこととなりました。
5【従業員の状況】
Section titled “5【従業員の状況】”(1)提出会社の状況
| 平成25年12月31日現在 | |||
| 従業員数(人) | 平均年齢(歳) | 平均勤続年数(年) | 平均年間給与(円) |
| 22 | 41.2 | 2.9 | 6,564,728 |
| セグメントの名称 | 従業員数(人) |
| 医薬品事業 | 4(0) |
| 検査薬事業 | 5(1) |
| 報告セグメント計 | 9(1) |
| 全社(共通) | 13(3) |
| 合計 | 22(4) |
(注)1.従業員数は就業人員であり、臨時雇用者数(人材会社からの派遣社員)は、年間の平均人員を()外数で記載しております。
2.平均年間給与は、賞与及び基準外賃金を含んでおります。
3.全社(共通)として記載されている従業員数は、特定のセグメントに区分できない管理部門に所属している
ものであります。
(2)労働組合の状況
労働組合は、結成されておりませんが、労使関係は円滑に推移しております。
第2【事業の状況】
Section titled “第2【事業の状況】”1【業績等の概要】
Section titled “1【業績等の概要】”(1)業績
当事業年度における我が国経済は、輸出環境の改善や経済政策、金融政策の効果を背景に緩やかな回復基調で推移しました。平成32年夏季オリンピック開催地が東京に決定するなど明るい話題に加え、株高・円安を背景にした景気回復への期待感から消費動向なども徐々に力強さがみられるようになりました。
当社が属する医薬品業界におきましても、平成25年には暦年基準で過去最多となる5社のバイオベンチャー企業が新規株式上場を果たし、株式市場からの注目を集めています。
このような状況下、当社はより一層の経営の効率化を図り、研究・開発・ライセンス活動を展開いたしました。
医薬品事業における状況は以下の通りです。
平成22年12月にBristol-Myers Squibb Co.(米国)とライセンス契約締結に至りました新規抗HIV剤OBP-601は、現在までに契約一時金に加え2回の開発マイルストーン収入を受領しています。平成24年2月には、Bristol-Myers Squibb Co.が実施するPhase-IIb試験の投薬が開始され、当社はマイルストーン収入を受領しました。世界17か国94施設で実施中のPhase-IIb試験は順調に進み、試験対象患者の組入れが完了しています。
腫瘍溶解ウイルスのOBP-301 (テロメライシンⓇ)は、平成20年3月にMedigen Biotechnology Corp.(台湾)と締結した戦略的アライアンス契約に基づき、米国で承認を得たプロトコールに基づく韓国及び台湾での肝臓癌を対象としたPhase-I/II臨床試験の準備が進められています。また、岡山大学における食道癌を対象とした臨床研究では、同大大学院医歯薬学総合研究科 藤原俊義教授(消化器外科学)らの研究グループによって日本人への投与が開始されました。
平成21年10月にアステラス製薬株式会社より導入いたしましたエピジェネティック癌治療薬OBP-801につきましては、NEDO(独立行政法人新エネルギー・産業技術総合開発機構)の「イノベーション実用化ベンチャー支援事業」に採択され、米国で追加前臨床試験を実施しました。また、臨床試験用製剤の製造を進めています。
この結果、医薬品事業における売上高はなし(前年同期は394,850千円の売上高)、営業損失は154,215千円(前年同期は262,610千円の営業利益)となりました。
検査薬事業における状況は以下の通りです。
当社が開発を進めています血中浮遊癌細胞(CTC)検査薬は、検査精度の向上を図るために、平成25年8月にOBP-401(テロメスキャン)から次世代ウイルスであるOBP-1101(テロメスキャンF35)への切り替えを行いました。現在、国内大学病院等と共同研究契約を締結し、事業化に向け患者の血液検体を用いたフィージビリティスタディを継続しています。また、平成25年12月には、WONIK CUBE Corp.(韓国)と韓国における事業ライセンス契約に向けた交渉を開始することについて合意しました。
この結果、検査薬事業における売上高は1,180千円(前年同期比38.0%減)、営業損失は160,052千円(前年同期は131,256千円の営業損失)となりました。
以上の結果、当事業年度は、売上高1,180千円(前年同期比99.7%減)、営業損失665,462千円(前年同期は営業損失140,954千円)を計上しました。また、経常損失は、円安による為替差益42,206千円の発生、製薬会社及び医療機関からの受取研究開発負担金21,280千円の受領、株式上場に伴う株式交付費39,681千円の支払いなどにより、625,302千円(前年同期は経常損失98,810千円)となりました。当期純損失は、神戸検査センターの一部検査機器の減損損失7,891千円などにより、635,553千円(前年同期は当期純損失102,829千円)となりました。
(2)キャッシュ・フロー
当事業年度末における現金及び現金同等物は、5,404,610千円となりました。当事業年度における各キャッシュ・フローは次のとおりです。
(営業活動によるキャッシュ・フロー)
営業活動によるキャッシュ・フローは598,528千円の支出となりました。これは主として、税引前当期純損失663,193千円、減価償却費17,139千円、未払金の増加11,729千円等によるものです。
(投資活動によるキャッシュ・フロー)
投資活動によるキャッシュ・フローは110,458千円の収入となりました。これは、主に定期預金の預入による支出75,000千円、定期預金の払戻による収入187,138千円、有形固定資産の取得による支出678千円等によるものです。
(財務活動によるキャッシュ・フロー)
財務活動によるキャッシュ・フローは5,440,081千円の収入となりました。これは主として、株式の発行による収入5,232,936千円、長期借入れによる収入165,000千円等によるものです。
2【生産、受注及び販売の状況】
Section titled “2【生産、受注及び販売の状況】”(1)生産実績
該当事項はありません。
(2)受注状況
該当事項はありません。
(3)販売実績
当事業年度の販売実績をセグメントごとに示すと、次のとおりであります。
| セグメントの名称 | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | 前年同期比(%) |
| 医薬品事業(千円) | - | - |
| 検査薬事業(千円) | 1,180 | △38.0 |
| 合計(千円) | 1,180 | △99.7 |
(注)1.最近2事業年度の主な相手先別の販売実績及び当該販売実績の総販売実績に対する割合は次のとおりであります。
| 相手先 | 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | ||
| 販売高(千円) | 割合(%) | 販売高(千円) | 割合(%) | |
| Bristol-Myers Squibb Co. | 394,850 | 99.5 | - | - |
| WONIK CUBE Corp. | - | - | 1,000 | 84.7 |
| 独立行政法人国立病院機構 呉医療センター中国がんセンター | - | - | 180 | 15.3 |
2.上記の金額には、消費税等は含まれておりません。
3【対処すべき課題】
Section titled “3【対処すべき課題】”当社が、中・長期的に対処すべき課題として認識している事項は、以下の通りです。
(1)パイプラインの進捗
| パイプライン | 課題 | |
| 医薬品 事業 | OBP-601 | Bristol-Myers Squibb Co.の開発を適確に進捗させること。 |
| OBP-301 (テロメライシンⓇ) | 肝臓癌を対象としたPhase I/II試験及び、岡山大学での食道癌を対象とした臨床研究を遅滞なく推進させ、POCを確認すること。 | |
| OBP-801 (新規分子標的抗癌) | 前臨床試験を完了させ、腎臓癌を対象としたPhase I/II試験を完了させること。 | |
| OBP-AI-001 (新規C型肝炎治療薬候補品) | 作用機序を明らかにし、前臨床試験を完了させること。 | |
| OBP-AI-002 (新規HIV感染症治療薬候補品) | 合成展開を完了し、最適化合物を用いた前臨床試験を完了させること。 | |
| 検査薬 事業 | OBP-1101 (テロメスキャンⓇ) | 共同臨床研究により、OBP-1101(テロメスキャンF35)によるCTC検査の臨床的有用性を証明すること。 血中循環癌細胞の検出システムを自動化させ、血液検体の大量処理を可能にさせること。 |
| OBP-401 (テロメスキャンⓇ) | リウマチなどの炎症性疾患検査を対象とした特性解析・フィージビリティスタディを完了させること。 | |
| OBP-1102 (新規白血病検出ウイルス) | 白血病検査を対象としたウイルス遺伝子改変の最適化を行うこと。 |
医薬品事業に関しては、平成22年12月に新規抗HIV薬OBP-601のアライアンス(導出)を達成し、当社のキャッシュ・フローは大幅に改善され、OBP-601の開発はBristol-Myers Squibb Co.主導になりました。今後はライセンス契約が締結されていないパイプラインの開発を推進していくことが課題となっています。
腫瘍溶解ウイルスOBP-301(テロメライシンⓇ)は、肝臓癌を対象とした韓国・台湾でのPhase I/II臨床試験、並びに岡山大学で医師主導治験として実施中の食道癌を対象とした臨床研究を遅滞なく推進させPOCを確認します。OBP-801は前臨床試験を完了させ、腎臓癌を対象としたPhase I/II臨床試験を開始させます。新規C型肝炎治療薬候補品であるOBP-AI-001は、既に最適化合物が特定されており、現在その作用機序解明を行っています。作用機序が解明され次第、前臨床試験を開始させます。新規抗HIV治療薬候補品OBP-AI-002は、複数のリード化合物候補から最も活性の強い最適化合物が特定され次第、前臨床試験を開始させます。これらの活動を通じて、パイプラインを製薬企業へ導出が可能なレベルまで迅速にステージアップしていきます。
また、現在のパイプライン以外に、新規感染症治療薬候補品や大企業が取り組みにくいが医療現場のニーズが確実にあるオーファン疾患(薬事法上対象患者が5万人以下の稀な疾患)を中心に、新規パイプラインの導入を検討しています。
検査薬事業に関しては、OBP-1101(テロメスキャンF35)、OBP-401(テロメスキャン®)、OBP-1102による全く新しい癌や炎症性疾患の早期発見を目指した検査プラットホームを構築していきます。
特に、血中循環癌細胞(CTC)検査薬OBP-1101(テロメスキャンF35)に関しましては、乳癌や肺癌を対象とした共同臨床研究を開始させると共に、基幹病院や検査会社との提携により受託検査を拡大します。そのために検出システムの自動化を図り、血液検体の大量処理を実現します。また、さらに、CTC検査キットを製品化し、当社検査センター以外でも検査可能な状況検査ユニットを構築します。これらの活動を通じて、医療機関内に血中循環癌細胞CTC検査センターが開設されることを目指します。
(2)組織戦略の強化
組織戦略では、経営理念の浸透、人財の確保と成長、研究開発体制の強化、事業開発部門の強化、アウトソーシング戦略の推進の5つの課題があります。
a.経営理念の浸透
当社のミッションは「医療にイノベーションを起こすこと」であり、そのための経営理念は、次の通りです。
「私たちが求めて止まないのは、医療の“イノベーション”です。そのために、普段からの医学研鑽を惜しみません。少人数で大きな仕事を成し遂げてこそ、アドベンチャーと言えるでしょう。大企業に出来ないことこそ、私たちが成し遂げるべき目標です。いくら儲かるからではなく、どれだけの人を救えるかに価値観をもち、その結果としての利益を追求してゆきたいと考えます。経営者と社員だけではなく、株主様ともこの意識を共有してゆきます。常に透明な経営を心がけ、定期的な情報公開を行ってゆきます。社会貢献を目指す社会人として、常にコンプライアンスの遵守を心がけます。」
経営理念を役職員に浸透させ、経営理念に基づいた経営戦略の遂行を柔軟且つ活気を持って執り行う組織を構築することが、重要な経営課題です。そのために、経営理念を行動レベルに細分化した行動規範を策定し、役職員に行動規範の遵守を指導するとともに、経営トップが役職員に経営理念を語る機会を積極的に設定しています。その上で、研究開発部門とアライアンス締結を実施する事業開発部門が一元的に情報を共有することを第一義に組織を構築しています。また、経営戦略を立案する経営企画部門と社内リソースを管理する管理部門は、常にステークホルダーを意識し、コンプライアンス遵守を徹底します。さらに、今後は内部監査部門の強化を図り、経営理念および行動規範の浸透状況を初めとするモニタリング機能を充実させていきます。
b.人財の確保と成長
役職員個々の自発的な成長こそが当社の成長を支える必須要素です。その実現のために人財の採用・育成を積極的に推進します。社内外ネットワークを活用し、確かな技術・能力・成長意欲のある人財の採用を行い、併せてOJTや各種研修プログラムによる人財育成を行うことで、陣容の充実を図ります。また、業績評価を充実させ、業務のスピード及び質を最大化することに努めます。
c.研究開発体制の強化
当社の研究開発は、医薬品及び検査薬候補の探索・創製から前臨床試験及び初期臨床試験までを対象としています。従って、研究開発計画の企画立案ならびにその進捗管理を主たる業務とするプロジェクトリーダー人財の確保ならびに育成が重要な課題です。従いまして、引き続き研究開発部門の質的・量的充実化に努めます。また、研究機関との共同研究開発を通じて先進技術を取り込み、技術レベルの向上を図ると共に、経営理念を共有できるアウトソーシング先を積極的に活用し、ローコストかつハイレベルな研究開発体制の構築を行います。
d.事業開発部門の強化
当社は、癌治療薬領域においてウイルス製剤を用いており、この業界においては非常に特殊な製品の事業化を目指しています。従って、この領域に明るい事業開発担当者を確保・育成し、世界の製薬企業や臨床検査企業とのネットワークをより強固なものとし、当社のキャッシュ・フロー獲得に貢献する事業開発体制を構築します。さらに、検査薬事業におきましては、将来の検査キット販売の販路確保を目的とした病院やクリニックとのネットワーク形成を推進する人財の確保・育成が必要となります。
e.アウトソーシング戦略
アウトソーシングを主体とする当社のビジネスにおいて、その効率化は重要な課題であります。必要かつ十分な研究開発及び製造力の確保に向け、外部委託会社であるCRO(Contract Research Organization)及びCMO(Contract Manufacturing Organization)との関係を強化するために、定期訪問等による綿密なコンタクト体制をとるべく全組織に啓蒙しています。また、常に最良のアウトソーシング体制を確保するべく、各々の業務領域において特定の1社依存にならぬよう、セカンドコントラクターの探索及び関係構築も行います。
4【事業等のリスク】
Section titled “4【事業等のリスク】”当社の事業の状況、経理の状況等に関する事項のうち、投資者の判断に重要な影響を与える可能性のあるリスク要因には、以下のようなものがあります。
当社は、これらのリスク発生の可能性を認識した上で発生の回避及び発生した場合の対応に努める方針でありますが、本株式に関する投資判断は本項及び本項以外の記載事項を慎重に検討した上で行われる必要があると考えられます。
なお、文中の将来に関する事項は、別段の表示がない限り、本書提出日時点において、当社が判断したものであります。
医薬品及び検査薬の研究開発について
(1) 事業の内容について
① 研究開発投資が多額であることにかかる事項
当社が行う医薬品及び検査薬の研究開発は、その期間が長期にわたり、コストも多額であります。
当社は、保有するパイプラインにおいて初期の臨床試験までの開発を効率的に進める事に注力し、そこで得られた有効性と安全性のデータを以って製薬企業へのライセンス契約締結を実現することを、基本的な事業活動と位置付けています。ライセンス契約の締結により、後期臨床試験以降の開発費用はライセンス先の拠出となり当社が負担する開発コストを最小限に抑えることが可能となるとともに、契約一時金収入及びマイルストーン収入を確保することで、新規パイプラインへの再投資が実現することを事業サイクルとしております。
しかしながら、万一、ライセンス契約締結及び維持に支障が発生した場合は、当社の事業収入が減少し、新規パイプライン開発への再投資が困難になる可能性があります。また、ライセンス対象となるパイプラインの開発費用をライセンス先が負担しないため、当社に発生する多大な研究開発費負担が当社業績を圧迫し、結果として開発の大幅な遅れや開発中止といった事態に及んだ場合、当社の事業、財務状況及び業績に影響を与える可能性があります。
② パイプラインの安全性及び有効性にかかる事項
当社が開発する医薬品及び検査薬のパイプラインにおいて、安全性や有効性の評価に問題が発見された場合は、開発が大幅に遅れる可能性もしくは開発そのものを中止する可能性があります。
当社は、保有するパイプラインの安全性及び有効性の評価を確実なものとするために、
ⅰ)科学評価顧問等のネットワークを最大限活用したパイプライン価値の適正な評価
ⅱ)非臨床・前臨床段階における徹底的な安全性及び有効性の検証
ⅲ)PMDA(独立行政法人 医薬品医療機器総合機構)やFDA(米国食品医薬品局)等の監督官庁との治験申請事前ミーティング
等を実施し、パイプラインの安全性及び有効性評価のための情報をより効率的に収集できるように努めております。また、臨床試験の実施に当たっては、臨床試験のモニタリングを委託致しますCROと綿密なコンタクトを取り、常に最新の臨床現場情報を収集するとともに、医療専門家を交えたSRB(安全性評価委員会)を設置する等、最大の努力を行っております。
しかしながら、安全性及び有効性においてあらかじめ全ての可能性を想定することは困難であり、開発の大幅な遅れや開発中止もしくは国内外の監督官庁の承認が得られないといった事態に及んだ場合、当社の事業、財務状況及び業績に影響を与える可能性があります。
③ 法的規制にかかる事項
医薬品製造に関連する規制と致しまして薬事法があります。医薬品の前臨床試験においてはGLP(Good Laboratory Practice)、原薬等の製造においてはGMP(Good Manufacturing Practice)ならびに臨床試験においてはGCP(Good Clinical Practice)がそれぞれ定められており、その操作手順やQA/QCが確実に実施されている事が必須条件になっております。また、当社の検査薬についても、臨床現場で癌の診断に用いられるようにする為には、臨床性能試験を実施し、体外診断用医薬品として承認を受ける必要があります。当社はこれらの試験を全てアウトソーシングしており、当社が直接これらの法律または規制によって制約を受けている事項はありません。
また、当社は遺伝子組換えウイルス製剤を開発しておりますが、日本においては、平成12年に生物多様性条約特別締約国会議で採択された「生物の多様性に関する条約のバイオセーフティに関するカルタヘナ議定書(カルタヘナ議定書)」に準拠した国内法「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」(カルタヘナ法)の定めるところに従って開発・製造・販売を行っていく必要があります。当社は、国内のウイルス取扱施設において、文部科学大臣より「遺伝子組換え生物等の第二種使用等をする間に執る拡散防止措置の確認」について確認を得ております。
しかしながら、将来医薬品・ウイルス製造等に関する新たな法律や条例などが制定・施行される可能性があり、それにより当社の事業が何らかの制約を受ける可能性があります。
④ 技術革新にかかる事項
当社が推進する医薬品事業及び検査薬事業にかかる技術分野においては、いずれも技術革新及び進歩の度合いが著しく速いと考えられます。当社は、常に最新の技術情報の収集・集積に注力しておりますが、万一、医薬品及び検査薬の競合技術等が、当社の対応の及ばない状況下で格段の進歩を遂げた場合、当社の事業に影響を与える可能性があります。また、当該技術の導入等に多大な費用や時間を要する場合、当社の事業、財務状況及び業績に影響を与える可能性があります。
⑤ 競合にかかる事項
当社の業務領域と完全に一致する企業は国内に見当たりませんが、国内創薬系バイオ企業の研究開発の動向を適宜確認するとともに、海外も含めたウイルス製剤の研究・開発・販売の動向は注視しています。
医薬品事業において本書提出日時点で当社にて把握できている競合品としては、世界の多数企業が腫瘍溶解ウイルスの開発を行っている中、中国が最も先行しており、Shanghai Sunway Biotech Co.,Ltd.(上海)が当社と同じアデノウイルス製剤のOncorineを頭頸部癌を対象にすでに上市しておりますが、日米欧の主要国においてはすべて開発段階です。
欧米では遺伝子改変ヘルペスウイルスのOncoVex(Amgen社:米国)がメラノーマ(悪性黒色腫)を対象にPhase III臨床試験のprimary endpointに達しています。また、Poxウイルスを用いたJX-594(Jennerex社:米国)が肝臓癌を対象にPhase II臨床試験の段階にあります。タカラバイオは遺伝子変異ヘルペスウイルスをアメリカにて開発しており、Phase I臨床試験の段階にあります。当社のOBP-301(テロメライシンⓇ)は、食道癌や肝臓癌などを対象とすることで競合との差別化を図って参ります。
HIV感染症治療薬は、世界で既に30種類以上の製品が上市されていますが、未だにHIV感染症患者は増え続け、世界での開発競争が繰り広げられています。当社は、OBP-601について平成22年12月にBristol-Myers Squibb Co.(米国)へ導出し、同社において開発が進められております。HIV感染症治療薬市場において、現在売上基準でHIV感染症治療薬Viread(Gilead社:米国)及びVireadを含む合剤が最大シェアを有しますが、Vireadの特許が平成29年以降に米国で切れるため、安価なジェネリック医薬品が発売される可能性があります。万一、Bristol-Myers Squibb Co.社における開発が大幅に遅延した場合には、Vireadのジェネリック医薬品が市場に出るタイミングとOBP-601の上市が重なる可能性があり、当社の事業に影響を与える可能性があります。今後は、Bristol-Myers Squibb Co.の開発方針・市場戦略を注視して参ります。
検査薬事業において、当社が対象としている血中浮遊癌細胞(CTC)の検出分野では、現在Veridex社(J&Jグループ)のCellSearchシステムが唯一欧米にて薬事承認されており、既に乳癌・大腸癌・前立腺癌のCTC検出において使用されている他、その他多数の検査機器による開発競争が激化しております。しかしながら、CellSearchをはじめとする競合の多くは、EpCAMと呼ばれる細胞表面マーカーを検出する方法を用いていますが、その細胞表面マーカーの発現が低いと言われている肺癌細胞等の検出が困難であるという欠点を持っております。一方、OBP-1101(テロメスキャンF35)は当社の実験において肺癌細胞をはじめとし、ほとんどの種類の癌細胞を蛍光発光させることが可能であることが判明しており、競合品との差別化を行っていく予定です。
いずれの開発領域におきましても、本書提出日時点、当社が把握する競合の存在及びその研究開発進捗が必ずしも当社にとって直接マイナスの影響をもたらすものではありませんが、競合品が飛躍的に市場を寡占化した場合等、当社のパイプライン導出や将来のロイヤリティ収入に影響を与える可能性があります。
⑥ アライアンスにかかる事項
当社の収益構造は、当社が研究開発する医薬品ならびに臨床検査薬について、その研究開発の進捗に伴って評価された製品的価値の初期評価であるProof of Concept(POC)に基づいて製薬企業等とのライセンス契約を締結し、その対価として契約一時金・研究協力金・開発協力金・マイルストーン収入及び製品の上市以降その販売に伴って発生するロイヤリティ収入等を段階的に見込むものであります。
当社は、現時点において、HIV感染症治療薬OBP-601がBristol-Myers Squibb Co.に導出済みであり、その他のパイプラインは製品的価値の初期評価であるProof of Concept(POC)獲得に向けた研究開発段階にあります。
導出前の各パイプラインにおきましては、導出先候補となる製薬企業や検査薬企業等のニーズを考慮し、研究開発の進捗状況を効果的に情報提供する等の活動を続けており、既にアライアンス交渉下にあるものも存在しております。しかしながら、当社のパイプラインが導出先候補企業のニーズを満たす保証はなく、導出に至らない、または導出契約の時期や条件が当社の想定するものと大幅に乖離した場合等において、当社の事業、財務状況及び業績に影響を与える可能性があります。
また導出済みのパイプラインにおきましては、今後の研究開発・承認申請・製造及び販売活動を導出先企業が行なう事になるため、当社の収益は導出先企業の戦略及び開発進捗等に依存することとなります。導出先企業が実施する臨床試験において予期せぬ副作用が発生した場合、及び導出先企業における戦略変更によるポートフォリオの見直し等により、導出済みパイプラインの開発中止等の決定がなされた場合、当社の事業、財務状況及び業績に影響を与える可能性があります。
尚、予期せぬ副作用により開発中止された場合を除き、当社は速やかに引継導出先を見つける活動を行いますが、引継導出先が早期に決定しない場合は、当社の事業、財務状況及び業績に影響を与える可能性があります。
⑦ 為替相場変動リスクにかかる事項
現在、当社の業務委託先及び提携先については、欧米の企業・機関がその大半を占めております。外貨建取引は、財務諸表上全て円換算しております。これらの項目は、現地通貨における価値が変化しなかった場合も、換算時のレートによって円換算後の価値が影響を受ける可能性があります。
為替相場の変動に起因する影響を軽減するために、必要に応じて為替予約などのリスクヘッジを行って参りますが、これによって全てのリスクを回避することは困難であり、当社の事業、財務状況及び業績に影響を与える可能性があります。
(2) 知的財産権について
① 特許にかかる事項
当社は、本書提出日時点において、当社の事業に対する特許権等の知的財産権に関する第三者との間での苦情及び訴訟等といった問題は認識しておりません。さらに、社内に知的財産権の専任担当者を設置するとともに、顧問弁護士及び弁理士との連携を以って可能な限り特許侵害・被侵害のリスクを軽減すべく活動しております。また、発明者、TLO法に基づく大学等の知的財産管理機関、企業及び研究機関から、「特許権又は特許を受ける権利」を正当に譲り受け、又は「実施権の許諾」を受け、事業化が推進できる体制を築いております。
しかし、当社の展開する医薬品・検査薬事業の一般的なリスクとして、自社で出願した特許以外にも第三者特許が関連する可能性があります。なお、今後、当社が第三者との間で係争に巻き込まれた場合、当社は弁護士や弁理士との協議の上、その内容に応じて対応策を検討していく方針でありますが、係争の解決に労力、時間及び費用を要する可能性があり、その場合、当社の財政状態及び経営成績に影響を及ぼす可能性があります。また、将来的な事業展開においては、他社が保有する特許権等への抵触により、事業上の制約を受けるなど、当社の事業、財務状況及び業績に影響を与える可能性があります。
主力パイプラインにかかる主要な特許の状況は以下のとおりです。
| 対象 | 適応症 | 特許権者 | 当社 | 備考 |
| OBP-601 | HIV感染症 | Yale Universityほか | 世界における独占的実施権 | 日本及び米国を含む10カ国で物質に関する特許が成立。 全世界における独占的実施権をBristol-Myers Squibb Co.社に再許諾。 |
| OBP-301(テロメライシンⓇ) | 固形癌(食道癌・肝臓癌など) | 当社 関西ティー・エル・オー株式会社 | 特許権者 (*注) | 日本・米国を含む9カ国で物質に関する特許が成立。 |
| 新規分子標的抗癌剤 (OBP-801) | 各種癌 | アステラス製薬株式会社 | 世界における独占的実施権 | 日本・米国・欧州を含む20カ国で物質に関する特許が成立。 |
| OBP-401(テロメスキャンⓇ) | 癌検出 | 当社 | 特許権者 | 日本及び欧州を含む10カ国で物質に関する特許が成立。更に、OBP-301(テロメライシンⓇ)の項目に記載の特許によっても保護される。 |
| OBP-1101(テロメスキャンF35) | 癌検出 | 独立行政法人 医薬基盤研究所 | 世界における独占的実施権 | 対象特許は審査中であるが、更にOBP-301(テロメライシンⓇ)及びOBP-401(テロメスキャンⓇ)の項目に記載の特許によっても保護される。 |
| OBP-401(テロメスキャンⓇ) OBP-1101(テロメスキャンF35) | 癌の体外診断 | Geron Corporation | 世界における独占的実施権 | Geron Corporationが保有する複数の検査薬目的での全世界のhTERTプロモーター特許により保護される。 |
注:日本特許は当社と関西ティー・エル・オー株式会社との共有、日本以外の指定国における特許は当社単独保有であります。
② OBP-301(テロメライシンⓇ)にかかる事項
OBP-301(テロメライシンⓇ)は、関西ティー・エル・オー株式会社より「特許権又は特許を受ける権利」を正当に譲り受け、事業化が推進できる体制を築いておりますが、一部の要素について他社が保有する特許に関連しています。そのため、当該他社特許期間の満了前に製造販売承認を受け、製造販売を開始する場合には、当該他社特許のライセンスを受ける必要があります。また、当該他社特許期間の満了前にOBP-301(テロメライシンⓇ)を他社にライセンス導出する場合には、当該他社特許のライセンス導入を受ける必要性を、ライセンスア導出契約先が考慮することになります。
OBP-301(テロメライシンⓇ)は、現在の臨床開発計画上、順調に開発が進んだとしても、製造販売承認を受ける時期は当該他社特許期間の満了以降であります。また、当社は、本書提出日時点において、当該他社特許権者との間での苦情及び訴訟等といった問題は認識しておりません。
当社は、必要に応じて当該他社特許のライセンス導入に努めてまいりますが、万一、適時に当該他社特許のライセンス導入を受けることができない場合には、当該他社特許の満了時期まで製造販売を開始する時期やライセンス導出する時期を遅らせなければならないことも想定され、当社の事業、財務状況及び業績に影響を与える可能性があります。
③ 職務発明にかかる事項
当社における職務発明の取扱に関しては、取締役・従業員が協議の上、取締役会決議により「職務発明規程」を作成し、運用しております。しかしながら、将来、発明者の認定及び職務発明の対価の相当性についての係争が発生した場合、当社の事業、財務状況及び業績に影響を与える可能性があります。
(3) 経営上の重要な契約について
当社の経営上重要と思われる契約の概要は、「第2 事業の状況 5 経営上の重要な契約等」に記載の通りであります。当該契約が期間満了、解除、その他の理由に基づき終了した場合、もしくは当社にとって不利な改定が行なわれた場合、または契約の相手方の経営状態が悪化したり、経営方針が変更されたりした場合には、当社の事業戦略及び業績に影響を与える可能性があります。
(4) 社内体制について
① 特定人物への依存にかかる事項
当社の事業活動においては、当社代表取締役社長である浦田泰生の製薬企業での経験・知識に基づく研究開発及び事業開発戦略に依るところが多く存在しております。浦田泰生の経営ビジョンを、企業理念・経営戦略として明確化して組織に浸透させること、及び後継者育成に専心し、浦田泰生に一元依存しない体制を構築することに努めております。
しかしながら、組織強化や後継者育成が遅れをきたした場合、それにより当社の事業、財務状況及び業績に影響を与える可能性があります。
② 小規模組織である事にかかる事項
当社は、小規模な組織であり、社内における管理体制についてもこの規模に応じたものとなっております。当社においては、業務上必要な人員の増員及び育成等を図っていく方針でありますが、各部門において従業員に業務遂行上の支障が生じた場合、人財流出が生じかつ代替要員の不在等の問題が生じた場合には、当社の事業、財務状況及び業績に影響を与える可能性があります。
③ 人財育成・確保にかかる事項
当社が成長を続けていくために不可欠な要素の一つが、優秀な人財の確保であります。
当社はアウトソーシングを活用したファブレス経営モデルを構築することで、必要人員の絶対数を削減し、統括的なプロジェクトマネジメント能力を有する人財を重点的に確保しつつ、将来当社を担う人財の育成に注力しております。
また、経営理念を社内に浸透させ、その崇高な目的に共感できる従業員を育成すること、トップが率先して基幹人財間のコミュニケーションの充実に関与すること、及び社内の評価制度や人事制度を充実させること等により、社内人財の定着率向上に努めております。
しかしながら、人財育成が円滑に進まない場合、又は各部門において中心的役割を担う特定の従業員が万一社外に流出した場合、当社の事業、財務状況及び業績に影響を与える可能性があります。
(5) 業務上の事故やトラブル等のリスクについて
① 重篤な副作用などにかかる事項
当社の医薬品事業において、パイプラインの有効性及び安全性を評価するため、十分な前臨床試験を実施した上で人体に対する初期臨床試験を行なっております。臨床試験段階にあるパイプラインにおける安全性の確認実施状況は、以下の通りであります。
HIV感染症治療薬OBP-601については、前臨床試験の安全性評価結果を以って、FDA(米国食品医薬品局)に治験申請を行い、平成20年5月から同年9月まで、米国ニュージャージー州の臨床試験施設において、健康成人男性に対するPhase I臨床試験を実施致しました。その結果、臨床上問題となる副作用は認められませんでした。その後、Phase I臨床試験の結果を以ってAFSSAPS(フランス保健製品衛生安全庁)の許可を得てHIV患者を対象としたPhase Ib/Ⅱa臨床試験を実施しており、同臨床試験においても臨床上問題となる副作用は認められておりません。さらに、導出先であるBristol-Myers Squibb Co.において実施されました長期毒性試験の安全性評価結果を以て、現在メガファーマであるBristol-Myers Squibb Co.の厳しい安全性評価の下でPhase IIb臨床試験が実施中であり、本書提出日時点まで臨床上問題となる副作用が発生したとの報告はございません。
腫瘍溶解ウイルス製剤OBP-301(テロメライシンⓇ)については、当社がこれまでに実施した動物実験等の前臨床試験では、様々な癌細胞に対して優れた抗腫瘍効果を示し、毒性試験においても安全性上問題となるような所見を示しませんでした。その結果、FDA(米国食品医薬品局)/CBER(生物医薬品局)から許可を得て、各種固形癌患者を対象としたPhase I臨床試験を実施致しました。Phase I臨床試験では腫瘍局所への投与を行い、米国において4群22例の投与を完了致しました結果、臨床上問題となる副作用は認められませんでした。
さらに今後開発・導入する新規パイプラインにおいても、上記と同等の安全性確認を行ったうえで、事業化を進める予定です。
臨床試験の実施に当たっては、臨床試験のモニタリング等を委託致しているCRO(受託臨床試験機関)とは常時綿密なコンタクトを取り、また医療専門家を交えたSRB(安全性評価委員会)を設置することによって、臨床試験の安全な実行に対して最大の努力を図っております。加えまして、治験保険への加入による損害賠償リスクの移転を図っております。
上記のような対策を行ってはおりますが、予期せぬ副作用による開発の遅滞・中止のリスクを完全に排除することは困難であり、当社の事業、財務状況及び業績に影響を与える可能性があります。
② 研究施設における事故等の発生にかかる事項
当社は、神戸に検査センター施設を保有しております。同センターで遺伝子組み換えウイルスを検査薬として取り扱うにあたっては、いわゆるカルタヘナ法の定めに基づき、必要な設備を監督官庁に届け出てその確認を受けております。また、遺伝子組み換えウイルスの取扱に関して、その管理方法を教育指導し徹底した予防管理に努めております。しかしながら、何らかの要因により火災や環境汚染事故等が発生した場合には、重大な損失を招くリスクがあり、当社の事業、財務状況及び業績に影響を与える可能性があります。
③ 自然災害等にかかる事項
当社は、東京都港区に本社を設置しており、事業活動に関わる資料・データ及び人員の半数以上が本社に集中しております。万一、首都圏直下型の大型地震の発生・台風・津波等の自然災害や大規模な事故・火災・テロ行為等により本社社屋の倒壊、資料・データの散逸、人員の死傷等不測の事態が発生した場合には、事業活動の継続が困難となる状況が生じ、当社の事業、財務状況及び業績に影響を与える可能性があります。
④ 訴訟にかかる事項
当社は知的財産権及びその実施権をビジネスの基盤としておりますため、事業を展開する上で、当社の責任の有無に関わらず、第三者から権利または利益を侵害したとの主張による損害賠償請求訴訟を提起される可能性があります。また、臨床試験において被験者の健康被害が発生した場合、取引関係や労使関係において不測のトラブルが発生した場合等においても、損害賠償請求等の訴訟を提起される可能性があります。当社では、十分な知的財産権の管理や治験保険への加入等リスクの回避・低減に努めております。しかしながら、訴訟が提起された結果、金銭的負担の発生や当社に対する信頼・風評の低下により、当社の事業、財務状況及び業績に影響を与える可能性があります。
(6) その他
① 新株予約権にかかる事項
当社は役員、従業員及び社外協力者等に対して、当社事業及び研究開発へのモチベーションの向上を目的として、新株予約権(ストック・オプション)を付与しております。また今後も優秀な人財や社外協力者の確保のために同様の施策を実施する可能性があります。これらの新株予約権の行使が行われた場合には、当社の1株当たりの株式価値は希薄化し、当社株価形成に影響を与える可能性があります。また、今後も当社は引き続き優秀な人財の確保のためにストック・オプションをはじめとするインセンティブプランを継続して実施していくことを検討しており、新たな新株予約権の付与が実施される可能性があります。なお、当該新株予約権の状況及び内容につきましては、「第4 提出会社の状況 1.株式等の状況 (2) 新株予約権等の状況」をご覧下さい。
② 資金使途にかかる事項
当社が保有する資金は、主に既存パイプラインの研究開発費用、新規パイプラインの導入及びその研究開発費用に充当する考えです。当社が本書提出日時点で計画している資金使途は上記の通りですが、急激な事業環境の変化等により、計画通りに使用した場合においても、当初の想定どおりの成果が得られない場合があります。
5【経営上の重要な契約等】
Section titled “5【経営上の重要な契約等】”(1) 当社が開発許諾を受けたライセンス契約
| 契約締結日 | 契約の名称 | 相手先 | 契約の概要 |
| 平成17年3月31日 | 特許を受ける権利の譲渡に関する契約 | 藤原俊義、田中紀章、京哲、水口裕之、早川堯夫 | OBP-401(テロメスキャンⓇ)の特許を受ける権利の譲渡契約。 契約期間:特許存続期間 |
| 平成18年12月22日 | 特許持分譲渡契約 | 関西ティー・エル・オー株式会社 | OBP-301(テロメライシンⓇ)の特許に関する、日本国および指定国における一切の特許出願について、その持分の2分の1を当社へ譲渡する契約 契約期間:特許存続期間 |
| 平成21年10月2日 | YM753ライセンス契約 | アステラス製薬株式会社 | OBP-801の特許の全世界における独占的な実施権の許諾に関する契約 1.当社は、OBP-801の特許の全世界における独占的な実施権の許諾を受け、開発段階に応じた一時金、販売マイルストーン及びロイヤリティを支払う。 2.契約期間:特許の最長存続期間又は販売マイルストーンの支払い全てが履行されるまでのいずれか遅い方まで。但し、当社が2014年末までに臨床試験を開始できない場合、またはそれが確実となったと当社と合意する場合、アステラス製薬株式会社は契約を解除することができる。 |
| 平成23年2月16日 | 特許権譲渡契約書 | 関西ティー・エル・オー株式会社 | OBP-301(テロメライシンⓇ)の特許出願(日本を除く)の持分(2分の1)を当社へ譲渡する契約(*注) |
| 平成23年4月28日 | 特許実施許諾契約書 | 独立行政法人 医薬基盤研究所 | OBP-1101(テロメスキャンF35)の特許の全世界における独占的な実施権の許諾に関する契約 1.OBP-1101(テロメスキャンF35)の特許の全世界における独占的な実施権の許諾を受け、開発段階及び販売実績等に応じた一時金及びロイヤリティを支払う。 2.契約期間:特許存続期間 |
| 契約締結日 | 契約の名称 | 相手先 | 契約の概要 |
| 平成25年2月15日 | EXCLUSIVE COMMERCIAL LICENSE AGREEMENT | Geron Corporation | Geron Corporationが保有するhTERTプロモーター特許の全世界における癌に関連する検査用途での独占的な実施権の許諾に関する契約 1.当社が第三者に対してライセンス製品を販売するか、ライセンス製品販売のためにパートナーと契約を締結した場合、マイルストーン及びロイヤリティを支払う。 2.契約期間:当社の最後の支払い義務の履行まで |
| 平成25年4月3日 | Amended and Restated Exclusive License Agreement | Yale University | OBP-601の特許の全世界における独占的な実施権の許諾に関する契約 1.当社は、OBP-601の特許の全世界における独占的な実施権の許諾を受け、開発段階に応じたマイルストーン、ロイヤリティ及びサブライセンシーから受領した金銭の一定割合を支払う。また、当社株式上場時に一定の金銭を支払う。 2.契約期間:国ごとに特許存続期間または許諾製品の販売開始から10年間のいずれか遅い方まで |
(注) 平成18年12月22日付け特許持分譲渡契約及び本契約により、日本の特許は当社と関西ティー・エル・オー株式会社
の共有、海外指定国における特許及び特許出願は当社単独保有となりました。
(2) アライアンス契約ならびに当社が許諾するライセンス契約
| 契約締結日 | 契約の名称 | 相手先 | 契約の概要 |
| 平成22年12月14日 | Exclusive License Agreement | Bristol-Myers Squibb Co. | OBP-601の特許の全世界における独占的な実施権の許諾及び再許諾に関する契約 1.当社は、Bristol-Myers Squibb Co.に対しOBP-601及びそのバックアップ化合物の全世界における独占的な実施権(再許諾権付)を許諾する。 2.当社はBristol-Myers Squibb Co.より下記支払いを受ける。 <開発段階> a)契約一時金として250万米ドル b)各種開発マイルストーンの達成毎に総額1億850万米ドル <上市後> a)あらかじめ設定した純売上高の達成に応じて最大1億7,500万米ドルの販売マイルストーン b)あらかじめ逓増的に定められた純売上高の達成レベルに応じて、純売上高に対する8%~10%のロイヤリティ 3.契約期間(ロイヤリティ支払期間と同一) 権利許諾された国ごとに、(i)許諾製品の販売開始から10年間、あるいは(ii)当該権利許諾された各国において、 Bristol-Myers Squibb Co.が許諾製品を販売する際に侵害となる物質又は承認された使用方法を包含する許諾特許の有効な請求項のうち最後に満了する請求項が満了するまでのいずれか遅い時までロイヤリティは支払われる。 |
| 平成25年6月12日 | Strategic Business Agreement | Wonik Co., Ltd. | 当社パイプラインの一部について、韓国でのオプション権と中国での第一拒否権に関する契約。 契約期間:契約日から10年間。但し、2015年12月末までに権利行使しない場合、あるいは何ら資金提供しなかった場合は自動的に解約。 |
| 平成26年1月24日 | Amended and Restated Strategic Alliance and License Agreement | Medigen Biotechnology Corp. | OBP-301(テロメライシンⓇ)の特定適応症に関する共同開発契約 1.Medigen社主導の臨床試験実施 2.両社で開発費用を按分するが、当社負担が70万ドルを超えるまではその負担が免除される 3.契約期間:平成20年3月6日から特許満了日または先発権(データ保護期間、再審査機関等)満了日のどちらか遅い方まで。 |
6【研究開発活動】
Section titled “6【研究開発活動】”当社の当事業年度における研究開発費は、医薬品事業108,518千円、検査薬事業111,136千円、両セグメント共通12,804千円、合計232,458千円となりました。
なお、当事業年度における研究開発活動の状況は以下の通りです。
(1) 研究開発体制について
平成25年12月31日現在、研究開発部門は9名在籍しておりこれは総従業員数の40.9%に当たります。
(2) 研究開発活動について
① 医薬品事業
ⅰ)抗HIV薬 OBP-601の研究開発
OBP-601は、平成22年12月のBristol-Myers Squibb Co.への導出に伴い、同社において研究開発が推進されており、当社は同社へのデータ・資料・情報提供を行っております。Bristol-Myers Squibb Co.は平成25年12月31日現在、世界16か国94施設での多国間臨床試験となるPhase-IIb試験を実施中です。
ⅱ)腫瘍溶解ウイルス OBP-301(テロメライシンⓇ)の研究開発
OBP-301(テロメライシンⓇ)は、平成20年3月にMedigen Biotechnology Corp.(台湾)と締結致しました戦略的アライアンス契約に基づき、米国で承認を得たプロトコールに基づく肝臓癌を対象としたPhase-I/II臨床試験の準備を進めています。また、岡山大学の食道癌・頭頸部癌を対象とした放射線との併用療法に関する臨床研究において、平成25年11月に食道癌患者に対して第一例目の投与を行っています。
ⅲ)エピジェネティック癌治療薬 OBP-801の研究開発
平成21年10月にアステラス製薬株式会社より導入いたしましたOBP-801は、NEDO(独立行政法人新エネルギー・産業技術総合開発機構)の「イノベーション実用化ベンチャー支援事業」に採択され、米国で前臨床試験を実施しました。臨床試験用製剤の製造を進め、再発性腎臓癌を対象に早期の治験申請を目指しています。
また、国内大手製薬企業においてデューデリジェンスが行われており、同社と京都府立医科大学と当社のコラボレーションによる研究が継続されています。
ⅳ)新規感染症治療薬 OBP-AI-001~002の研究開発
鹿児島大学との共同研究契約の成果として、難治性ウイルス感染症に対する新規治療薬(抗HCV薬・抗HIV薬)の有力な候補化合物が見出されて参りました。今後これらについてリード化合物の最適化・作用機序の特定等の基礎研究を行って参ります。
② 検査薬事業
ⅰ)血中浮遊癌細胞(CTC)検査薬 OBP-1101(テロメスキャンF35)の研究開発
検査精度の向上を図るために、平成25年8月にOBP-401(テロメスキャン)から次世代ウイルスであるOBP-1101(テロメスキャンF35)への切り替えを行いました。現在、国内大学病院等と共同研究契約を締結し、事業化に向け臨床研究を継続しています。。このうち、子宮頸癌に関する金沢大学との共同研究は、JST(独立行政法人科学技術振興機構)の研究成果最適展開支援プログラム(A-STEP)の平成26年度「フィージビリティスタディ(FS)ステージ シーズ顕在化タイプ」に採択されました。
また、将来の医療機関によるCTC検査センター開設に向け、検出システムの自動化や、CTC検査キット及び検査ユニットの製品化に向けた研究開発を実施しています。
ⅱ)炎症性疾患検査薬 OBP-401(テロメスキャンⓇ)の研究開発
平成24年11月にはOBP-401 (テロメスキャンⓇ)が、JST(独立行政法人科学技術振興機構)の研究成果最適展開支援プログラム(A-STEP)の平成24年度「フィージビリティスタディ(FS)ステージ シーズ顕在化タイプ」に採択されました。現在、リウマチなどの炎症性疾患検査を対象とした特性解析・フィージビリティスタディに向けた研究開発を実施しています。
ⅲ)新規白血病検査薬 OBP-1102(テロメスキャンⓇ)の研究開発
ウイルス遺伝子改変の最適化に向けた国内医療機関とのフィージビリティスタディを目指し、研究開発を実施しています。
7【財政状態、経営成績及びキャッシュ・フローの状況の分析】
Section titled “7【財政状態、経営成績及びキャッシュ・フローの状況の分析】”文中の将来に関する事項は、本書提出日時点において当社が判断したものであります。
(1) 重要な会計方針及び見積り
当社の財務諸表は、わが国において一般に公正妥当と認められる企業会計の基準に準拠して作成されております。この財務諸表の作成にあたり、見積もりが必要な事項につきましては、合理的な基準に基づき、会計上の見積もりを行なっております。
(2) 財政状態の分析
(流動資産)
当事業年度末における流動資産は前事業年度末より4,900,534千円増加し、5,631,246千円となりました。その主な内訳は、現金及び預金5,579,610千円、製品19,523千円です。
(固定資産)
当事業年度末における固定資産は前事業年度末より4,250千円減少し、65,404千円となりました。その主な内訳は、建物10,187千円、工具、器具及び備品25,664千円、投資有価証券14,274千円です。
(流動負債)
当事業年度末における流動負債は前事業年度末より142,206千円増加し、232,928千円となりました。その主な内訳は、短期借入金154,672千円、未払金36,570千円、未払法人税等18,359千円です。
(固定負債)
当事業年度末における固定負債は前事業年度末より132,893千円増加し、370,063千円となりました。その主な内訳は、長期借入金343,328千円、リース債務15,194千円、資産除去債務6,074千円です。
(純資産)
当事業年度末における純資産は前事業年度末より4,621,184千円増加し、5,093,658千円となりました。その主な内訳は、資本金5,059,448千円、資本剰余金5,051,948千円、利益剰余金△5,041,625千円です。
(3) キャッシュ・フローの状況の分析
キャッシュ・フローの状況の分析については、「第2 事業の状況 1 業績等の概要」をご参照下さい。
(4) 経営成績の分析
経営成績の分析については、「第2 事業の状況 1 業績等の概要」をご参照下さい。
(5) 利益配分に関する基本方針
当社は、研究開発型ベンチャー企業として、先行投資的な事業資金等を支出してまいりました事により、これまで利益配当を実施しておりません。しかしながら、株主に対する利益還元を重要な経営課題として認識しており、経営基盤の一層の強化と積極的な事業展開に備えた内部留保の充実を勘案しながら、各期の経営成績を考慮に入れて配当政策を決定して参ります。
(6) 経営戦略の現状と見直しについて
当社は、医薬品ならびに検査薬の研究開発に注力し、その結果として早期に製品的価値の初期評価であるProof of Concept(POC)を達成し、その成果を以って主に欧米もしくは国内大手製薬企業等への導出による収益獲得を経営戦略として参りました。
特に平成22年12月に主力パイプラインである抗HIV薬OBP-601 のBristol-Myers Squibb Co.への導出を達成いたしましたことは、当社の経営戦略上大きな成果となりました。
今後も引続き現保有パイプラインの導出に向けた研究開発を推進致しますと共に、検査薬事業においては、検査会社・医療機関との検査ネットワーク構築に取り組んで参ります。
(7) 資本の財源及び資金の流動性について
当事業年度につきましては、売上並びに営業外収益による収入と研究開発費を含む販売費及び一般管理費等の支出により、営業活動によるキャッシュ・フローは598,528千円の支出となりました。また、定期預金の払戻や有形固定資産の取得等により、投資活動によるキャッシュ・フローは110,458千円の収入となりました。さらに、長期借入金や株式の発行等により、財務活動によるキャッシュ・フローは5,440,081千円の収入となりました。
以上の結果、現金及び現金同等物の期末残高は5,404,610千円となりました。
(8) 経営者の問題意識と今後の方針について
癌と重症感染症の医薬品・検査薬の創薬において、当社は平成22年12月に重症感染症の医薬品候補として抗HIV薬OBP-601の導出を果たしました。本医薬品候補化合物の今後のBristol-Myers Squibb Co.における開発進捗に全面的に協力することが、当社の重点課題でありますが、一方で創業以来の懸案である癌領域の分野において一日も早く患者様・医療関係者の福音となる医薬品・検査薬を開発・導出していくことが当社にとっての大きな命題であると認識しています。
まずは、全く新しい血中浮遊癌細胞(CTC)検査薬として、OBP-401 (テロメスキャンⓇ)を製品化すること、
併せて腫瘍溶解ウイルス製剤OBP-301(テロメライシンⓇ)を大手製薬企業への導出が可能なレベルまで開発を
進めることを今後の重点方針と考えております。
第3【設備の状況】
Section titled “第3【設備の状況】”1【設備投資等の概要】
Section titled “1【設備投資等の概要】”当社は、平成25年12月期において検査薬事業における検査設備等の拡充を図るため、神戸検査センターにおいて14,878千円の設備投資を行いました。
2【主要な設備の状況】
Section titled “2【主要な設備の状況】”当社における主要な設備は、次のとおりであります。
(1)提出会社
| 平成25年12月31日現在 |
| 事業所名 (所在地) | セグメント の名称 | 設備の内容 | 帳簿価額 | 従業員数 (人) | |||
| 建物 (千円) | 機械及び装置 (千円) | その他 (千円) | 合計 (千円) | ||||
| 神戸検査センター (兵庫県神戸市中央区) | 検査薬事業 | オフィス 検査施設 | 6,792 | - | 22,377 | 29,170 | 7 |
(注)1.上記金額には消費税等は含まれておりません。
2.当社はリース資産について全てオンバランスにしております。
3.従業員数は、就業人員数であります。
4.当社の事業所は全て賃借中のものであります。なお、上記建物の内訳は主として造作物であります。賃借している主要な設備として以下のものがあります。
| 平成25年12月31日現在 | |||||
| 事業所名 (所在地) | セグメントの名称 | 設備の内容 | 従業員数 (人) | 土地面積 (㎡) | 年間賃借料 又はリース料 (千円) |
| 本社 (東京都港区) | 医薬品事業・共通 | オフィス オフィス | 15 | 158.41 70.28 | 9,200 3,316 |
| 神戸検査センター (兵庫県神戸市中央区) | 検査薬事業・共通 | オフィス 検査施設 | 7 | 81.80 204.00 | 3,870 12,240 |
3【設備の新設、除却等の計画】
Section titled “3【設備の新設、除却等の計画】”当社の設備投資については、景気予測・業界動向・投資効率等を総合的に勘案して策定しております。
なお、重要な設備の新設、除却計画はありません。
第4【提出会社の状況】
Section titled “第4【提出会社の状況】”1【株式等の状況】
Section titled “1【株式等の状況】”(1)【株式の総数等】
Section titled “(1)【株式の総数等】”①【株式の総数】
Section titled “①【株式の総数】”| 種類 | 発行可能株式総数(株) |
| 普通株式 | 20,000,000 |
| 計 | 20,000,000 |
②【発行済株式】
Section titled “②【発行済株式】”| 種類 | 事業年度末現在発行数(株) (平成25年12月31日) | 提出日現在発行数(株) (平成26年3月27日) | 上場金融商品取引所名又は登録認可金融商品取引業協会名 | 内容 |
| 普通株式 | 9,076,900株 | 9,183,000 | 東京証券取引所 (マザーズ) | 完全議決権株式であり、株主としての権利内容に何ら限定のない当社における標準となる株式であり、単元株式数は100株であります。 |
| 計 | 9,076,900株 | 9,183,000 | - | - |
(注)「提出日現在発行数」欄には、平成26年3月1日からこの有価証券報告書提出日までの新株予約権の行使により発行された株式数は含まれておりません。
(2)【新株予約権等の状況】
Section titled “(2)【新株予約権等の状況】”会社法第236条、第238条及び第239条の規定に基づき発行した新株予約権は、次のとおりであります。
平成22年10月26日臨時株主総会決議 「第10回新株予約権」
| 区分 | 事業年度末現在 (平成25年12月31日) | 提出日の前月末現在 (平成26年2月28日) |
| 新株予約権の数(個) | 1,997(注)1 | 1,997(注)1 |
| 新株予約権のうち自己新株予約権の数(個) | - | - |
| 新株予約権の目的となる株式の種類 | 普通株式 | 同左 |
| 新株予約権の目的となる株式の数(株) | 199,700(注)1,4 | 199,700(注)1,4 |
| 新株予約権の行使時の払込金額(円) | 200(注)2,4 | 200(注)2,4 |
| 新株予約権の行使期間 | 平成24年11月1日から 平成32年10月26日まで | 同左 |
| 新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額(円) | 発行価格 200(注)4 資本組入額 100(注)4 | 発行価格 200(注)4 資本組入額 100(注)4 |
| 新株予約権の行使の条件 | (注)3 | (注)3 |
| 新株予約権の譲渡に関する事項 | (注)3 | (注)3 |
| 代用払込みに関する事項 | - | - |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | - | - |
(注)1.「新株予約権の数」及び「新株予約権の目的となる株式の数」は、権利行使により減少した個数及び株式の数並びに退職等により権利を喪失した者の個数及び株式の数は除外しており、新株予約権1個につき目的となる株式の数は1株であります。
なお、当社が当社普通株式の株式分割(株式無償割当てを含む。)又は株式併合を行う場合には、その時点で新株予約権者が権利行使又は消滅していない新株予約権の目的たる株式の数についてのみ、次の算式により調整される。但し、調整の結果1株未満の端数が生じた場合は、これを切り捨てるものとします。
調整後株式数 = 調整前株式数 × 分割・併合の比率
上記のほか、当社が他社と合併、会社分割、株式交換又は株式移転する場合、資本金の額の減少を行う場合、その他これらの場合に準じ、割当株式数の調整を必要とする場合には、当社取締役会は、必要かつ合理的な範囲で、目的たる株式の数の調整を行うことができることとします。
2. (1) 株式分割(株式無償割当てを含む。)又は株式併合を行う場合には、次の算式により払込金額を調整し、調整により生ずる1円未満の端数は切り上げます。
1
調整後払込金額 = 調整前払込金額×――――――――――
分割・併合の比率
(2) 一般的に公正妥当とされる時価を下回る払込金額で、当社普通株式につき、新株式の発行又は自己株式を処分した場合(会社法第194条の規定(単元未満株主による単元未満株式売渡請求)に基づく自己株式の売渡し、当社普通株式に転換される証券もしくは転換できる証券又は当社普通株式の交付を請求できる新株予約権(新株予約権付社債に付されたものを含む。)の転換又は行使の場合を除く。)は、次の算式により払込金額を調整し、調整により生ずる1円未満の端数は切り上げます。
1株当たり
新規発行株式数 × 払込金額
既発行 + ―――――――――――――――――
調整後 調整前 株式数 新規発行前の株価
払込 =払込 × ―――――――――――――――――――――――――――――――――
金額 金額 既発行株式数+新規発行株式数
上記の算式において「既発行株式」とは、当社の発行済普通株式総数から当社の保有する普通株式に係る自己株式の総数を控除した数とし、自己株式の処分を行う場合には「新規発行株式数」を「処分する株式数」に、「1株当たり払込金額」を「1株当たり処分金額」に、「新規発行前の株価」を「処分前の株価」に、それぞれ読み替えるものとします。
(3) 上記のほか、資本金の額の減少を行う場合など、払込金額の調整を必要とする場合には、当社取締役会は、必要かつ合理的な範囲で、払込金額の調整を行うことができることとします。
3.新株予約権の行使の条件
(1) 新株予約権者は、権利行使時においても、当社及び当社子会社並びにグループ会社の取締役、執行役員、従業員又は監査役、並びに当社の顧問、開発アドバイザー、社外協力者、コンサルタントの地位にあることを要します。但し、任期満了による退任、定年退職その他正当な理由がある場合はこの限りではありません。
(2) 新株予約権者に、法令、定款もしくは社内規則に違反する行為があった場合又は新株予約権者が当社と競業関係にある相手先の取締役、執行役員、監査役、使用人、嘱託、顧問、開発アドバイザー、社外協力者又はコンサルタントとなった場合等、新株予約権の発行の目的上、新株予約権者に本新株予約権を行使させることが相当でないとされる事由が生じた場合は、新株予約権を行使できないものとします。
(3) 新株予約権の譲渡、質入その他一切の処分は認められないものとします。
(4) 新株予約権者が死亡した場合は、その相続人による本新株予約権の相続を認めます。
(5) 新株予約権者は、新株予約権の全部又は一部を行使することができます。
(6) 当社と新株予約権者との間で締結する新株予約権割当契約に違反していないこと。
4.当社は、平成25年3月27日付で株式1株につき100株の株式分割を実施しているため、「新株予約権の目的となる株式の数」、「新株予約権の行使時の払込金額」及び「新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額」が調整されております。
平成22年10月26日臨時株主総会決議 「第11回新株予約権」
| 区分 | 事業年度末現在 (平成25年12月31日) | 提出日の前月末現在 (平成26年2月28日) |
| 新株予約権の数(個) | 1,050(注)1 | 1,050(注)1 |
| 新株予約権のうち自己新株予約権の数(個) | - | - |
| 新株予約権の目的となる株式の種類 | 普通株式 | 同左 |
| 新株予約権の目的となる株式の数(株) | 105,000(注)1,4 | 105,000(注)1,4 |
| 新株予約権の行使時の払込金額(円) | 200(注)2,4 | 200(注)2,4 |
| 新株予約権の行使期間 | 平成22年10月26日から 平成28年12月31日まで | 同左 |
| 新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額(円) | 発行価格 200(注)4 資本組入額 100(注)4 | 発行価格 200(注)4 資本組入額 100(注)4 |
| 新株予約権の行使の条件 | (注)3 | (注)3 |
| 新株予約権の譲渡に関する事項 | (注)3 | (注)3 |
| 代用払込みに関する事項 | - | - |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | - | - |
(注)1.「新株予約権の数」及び「新株予約権の目的となる株式の数」は、権利行使により減少した個数及び株式の数並びに退職等により権利を喪失した者の個数及び株式の数は除外しており、新株予約権1個につき目的となる株式の数は1株であります。
なお、当社が当社普通株式の株式分割(株式無償割当てを含む。)又は株式併合を行う場合には、その時点で新株予約権者が権利行使又は消滅していない新株予約権の目的たる株式の数についてのみ、次の算式により調整されます。但し、調整の結果1株未満の端数が生じた場合は、これを切り捨てるものとします。
調整後株式数 = 調整前株式数 × 分割・併合の比率
上記のほか、資本金の額の減少を行う場合など、割当株式数の調整を必要とする場合には、当社取締役会は、必要かつ合理的な範囲で、目的たる株式の数の調整を行うことができることとします。
2. (1) 株式分割(株式無償割当てを含む。)又は株式併合を行う場合には、次の算式により払込金額を調整し、調整により生ずる1円未満の端数は切り上げます。
1
調整後払込金額 = 調整前払込金額 × ――――――――――
分割・併合の比率
(2) 一般的に公正妥当とされる時価を下回る払込金額で、当社普通株式につき、新株式の発行又は自己株式を処分した場合(会社法第194条の規定(単元未満株主による単元未満株式売渡請求)に基づく自己株式の売渡し、当社普通株式に転換される証券もしくは転換できる証券又は当社普通株式の交付を請求できる新株予約権(新株予約権付社債に付されたものを含む。)の転換又は行使の場合を除く。)は、次の算式により払込金額を調整し、調整により生ずる1円未満の端数は切り上げます。
1株当たり
新規発行株式数 × 払込金額
既発行 + ──────────────――
調整後 調整前 株式数 新規発行前の株価
払込 =払込 × ──────────────────―――――――――
金額 金額 既発行株式数+新規発行株式数
上記の算式において「既発行株式」とは、当社の発行済普通株式総数から当社の保有する普通株式に係る自己株式の総数を控除した数とし、自己株式の処分を行う場合には「新規発行株式数」を「処分する株式数」に、「1株当たり払込金額」を「1株当たり処分金額」に、「新規発行前の株価」を「処分前の株価」に、それぞれ読み替えるものとします。
(3) 上記のほか、資本金の額の減少を行う場合など、払込金額の調整を必要とする場合には、当社取締役会は、必要かつ合理的な範囲で、払込金額の調整を行うことができることとします。
3.新株予約権の行使の条件
(1) 新株予約権者は、権利行使時においても、当社取締役会が認める範囲内で、当社及び当社子会社並びにグループ会社と友好な提携先の地位にあることを要します。
(2) 新株予約権者に、法令、定款もしくは社内規則に違反する行為があった場合又は新株予約権の発行の目的上、新株予約権者に本新株予約権を行使させることが相当でないと、当社取締役会が認める事由が生じた場合は、新株予約権を行使できないものとします。
(3) 新株予約権の譲渡、質入その他一切の処分は認められないものとします。
(4) 新株予約権者の相続、合併、会社分割、株式交換又は株式移転等による一切の承継は認められないものとします。
(5) 新株予約権者は、新株予約権の全部又は一部を行使することができます。
(6) 当社と新株予約権者との間で締結する新株予約権割当契約に違反していないこと。
(7) 当社が取締役会決議に基づき上記以外の行使の条件を定めた場合、かかる条件を遵守して新株予約権を行使するものとします。新株予約権者は、権利行使時においても、当社の株主の地位にあることを要します。
4.当社は、平成25年3月27日付で株式1株につき100株の株式分割を実施しているため、「新株予約権の目的と
なる株式の数」、「新株予約権の行使時の払込金額」及び「新株予約権の行使により株式を発行する場合の
株式の発行価格及び資本組入額」が調整されております。
平成23年12月6日臨時株主総会決議 「第12回新株予約権」
| 区分 | 事業年度末現在 (平成25年12月31日) | 提出日の前月末現在 (平成26年2月28日) |
| 新株予約権の数(個) | 5,331(注)1 | 5,331(注)1 |
| 新株予約権のうち自己新株予約権の数(個) | - | - |
| 新株予約権の目的となる株式の種類 | 普通株式 | 同左 |
| 新株予約権の目的となる株式の数(株) | 533,100(注)1,4 | 533,100(注)1,4 |
| 新株予約権の行使時の払込金額(円) | 1,000(注)2,4 | 1,000(注)2,4 |
| 新株予約権の行使期間 | 平成25年12月7日から 平成33年12月6日まで | 同左 |
| 新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額(円) | 発行価格 1,000(注)4 資本組入額 500(注)4 | 発行価格 1,000(注)4 資本組入額 500(注)4 |
| 新株予約権の行使の条件 | (注)3 | (注)3 |
| 新株予約権の譲渡に関する事項 | (注)3 | (注)3 |
| 代用払込みに関する事項 | - | - |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | - | - |
(注)1.「新株予約権の数」及び「新株予約権の目的となる株式の数」は、権利行使により減少した個数及び株式の数並びに退職等により権利を喪失した者の個数及び株式の数は除外しており、新株予約権1個につき目的となる株式の数は1株であります。
なお、当社が当社普通株式の株式分割(株式無償割当てを含む。)又は株式併合を行う場合には、その時点で新株予約権者が権利行使又は消滅していない新株予約権の目的たる株式の数についてのみ、次の算式により調整されます。但し、調整の結果1株未満の端数が生じた場合は、これを切り捨てるものとします。
調整後株式数 = 調整前株式数 × 分割・併合の比率
上記のほか、資本金の額の減少を行う場合など、割当株式数の調整を必要とする場合には、当社取締役会は、必要かつ合理的な範囲で、目的たる株式の数の調整を行うことができることとします。
2. (1) 株式分割(株式無償割当てを含む。)又は株式併合を行う場合には、次の算式により払込金額を調整し、調整により生ずる1円未満の端数は切り上げます。
1
調整後払込金額 = 調整前払込金額 × ――――――――――
分割・併合の比率
(2) 一般的に公正妥当とされる時価を下回る払込金額で、当社普通株式につき、新株式の発行又は自己株式を処分した場合(会社法第194条の規定(単元未満株主による単元未満株式売渡請求)に基づく自己株式の売渡し、当社普通株式に転換される証券もしくは転換できる証券又は当社普通株式の交付を請求できる新株予約権(新株予約権付社債に付されたものを含む。)の転換又は行使の場合を除く。)は、次の算式により払込金額を調整し、調整により生ずる1円未満の端数は切り上げます。
1株当たり
新規発行株式数 × 払込金額
既発行 + ──────────────――
調整後 調整前 株式数 新規発行前の株価
払込 =払込 × ──────────────────―――――――――
金額 金額 既発行株式数+新規発行株式数
上記の算式において「既発行株式」とは、当社の発行済普通株式総数から当社の保有する普通株式に係る自己株式の総数を控除した数とし、自己株式の処分を行う場合には「新規発行株式数」を「処分する株式数」に、「1株当たり払込金額」を「1株当たり処分金額」に、「新規発行前の株価」を「処分前の株価」に、それぞれ読み替えるものとします。
(3) 上記のほか、資本金の額の減少を行う場合など、払込金額の調整を必要とする場合には、当社取締役会は、必要かつ合理的な範囲で、払込金額の調整を行うことができることとします。
3.新株予約権の行使の条件
(1) 新株予約権者は、権利行使時においても、当社及び当社子会社並びにグループ会社の取締役、執行役員、監査役、従業員又は監査役、並びに当社の顧問、開発アドバイザー、社外協力者、コンサルタントの地位にあることを要します。但し、任期満了による退任、定年退職その他正当な理由がある場合はこの限りではありません。
(2) 新株予約権者に、法令、定款もしくは社内規則に違反する行為があった場合又は新株予約権者が当社と競業関係にある相手先の取締役、執行役員、監査役、使用人、嘱託、顧問、開発アドバイザー、社外協力者又はコンサルタントとなった場合等、新株予約権の発行の目的上、新株予約権者に本新株予約権を行使させることが相当でないとされる事由が生じた場合は、新株予約権を行使できないものとします。
(3) 新株予約権の譲渡、質入その他一切の処分は認められないものとします。
(4) 新株予約権者が死亡した場合は、その相続人による本新株予約権の相続を認めます。
(5) 新株予約権者は、新株予約権の全部又は一部を行使することができます。
(6) 当社と新株予約権者との問で締結する新株予約権割当契約に違反していないこと。
(7) 新株予約権者は1年間(1月1日から12月31日までの期間をいう。)における新株予約権の行使によって取得する株式の発行価額〔自己株式を譲り受ける場合には自己株式の処分価額〕の合計額が1200万円を超えないように、その保有する新株予約権を行使しなければなりません。
(8) 当社が取締役会決議に基づき上記以外の行使の条件を定めた場合、かかる条件を遵守して新株予約権を行使するものとします。
4.当社は、平成25年3月27日付で株式1株につき100株の株式分割を実施しているため、「新株予約権の目的となる株式の数」、「新株予約権の行使時の払込金額」及び「新株予約権の行使により株式を発行する場合の株式の発行価格及び資本組入額」が調整されております。
(3)【行使価額修正条項付新株予約権付社債券等の行使状況等】
Section titled “(3)【行使価額修正条項付新株予約権付社債券等の行使状況等】”該当事項はありません。
(4)【ライツプランの内容】
Section titled “(4)【ライツプランの内容】”該当事項はありません。
(5)【発行済株式総数、資本金等の推移】
Section titled “(5)【発行済株式総数、資本金等の推移】”| 年月日 | 発行済株式総数 増減数(株) | 発行済株式 総数残高(株) | 資本金 増減額 (千円) | 資本金 残高 (千円) | 資本準備金増減額 (千円) | 資本準備金残高 (千円) |
| 平成20年3月11日 (注)1 | 普通株式 7,418 | 普通株式 39,795 | 407,990 | 2,044,600 | 407,990 | 2,037,100 |
| 平成21年10月7日 (注)2 | A種類株式 3,636 | 普通株式 39,795 A種類株式 3,636 | 199,980 | 2,244,580 | 199,980 | 2,237,080 |
| 平成22年1月1日 ~12月31日(注)3 | 普通株式 7,000 | 普通株式 46,795 A種類株式 3,636 | 70,000 | 2,314,580 | 70,000 | 2,307,080 |
| 平成24年1月1日 ~12月31日(注)3 | 普通株式 12,840 | 普通株式 59,635 A種類株式 3,636 | 128,400 | 2,442,980 | 128,400 | 2,435,480 |
| 平成25年3月27日 (注)4 | 普通株式 5,903,865 A種類株式 359,964 | 普通株式 5,963,500 A種類株式 363,600 | - | 2,442,980 | - | 2,435,480 |
| 平成25年4月9日 (注)5 | 普通株式 727,200 | 普通株式 6,690,700 A種類株式 363,600 | - | 2,442,980 | - | 2,435,480 |
| 平成25年4月10日 (注)6 | A種類株式 △363,600 | 普通株式 6,690,700 | - | 2,442,980 | - | 2,435,480 |
| 平成25年12月5日 (注)7 | 1,820,000 | 普通株式 8,510,700 | 2,176,720 | 4,619,700 | 2,176,720 | 4,612,200 |
| 平成25年12月25日 (注)8 | 普通株式 333,000 | 普通株式 8,843,700 | 398,268 | 5,017,968 | 398,268 | 5,010,468 |
| 平成25年1月1日 ~12月31日(注)3 | 普通株式 233,200 | 普通株式 9,076,900 | 41,480 | 5,059,448 | 41,480 | 5,051,948 |
(注)1.有償第三者割当
発行価格 110,000円 資本組入額 55,000円
主な割当先 アント・リード2号投資事業有限責任組合 1,420株
SMBCキャピタル8号投資事業有限責任組合 1,364株
Medigen Biotechnology Corp. 936株 他16名
2.有償第三者割当(A種類株式)
発行価格 110,000円 資本組入額 55,000円
割当先 アステラス製薬株式会社 3,636株
3.新株予約権の行使による増加であります。
4.当社は、平成25年3月27日付で株式1株につき100株の株式分割を行っております。
5.平成25年3月19日開催の当社取締役会決議に基づき、平成25年4月9日付でA種類株式1株は普通株式2株に転換されております。
6.平成25年3月27日開催の当社取締役会決議に基づき、平成25年4月10日付でA種類株式はすべて消却されております。
7.有償一般募集(ブックビルディング方式による募集)
発行価格 2,600円
引受価額 2,392円
資本組入額 1,196円
払込金総額 4,353,440千円
8. 第三者割当
発行価格 2,600円
引受価格 2,392円
資本組入額 1,196円
払込金総額 796,536千円
主な割当先 SMBC日興証券株式会社 333,000株
9. 平成26年1月1日から平成26年2月28日までの間に、新株予約権の行使により、発行済株式総数が106,100株、資本金及び資本準備金がそれぞれ12,730千円増加しております。
(6)【所有者別状況】
Section titled “(6)【所有者別状況】”| 平成25年12月31日現在 | |||||||||
| 区分 | 株式の状況(1単元の株式数100株) | 単元未満株式の状況 (株) | |||||||
| 政府及び地方公共団体 | 金融機関 | 金融商品取引業者 | その他の法人 | 外国法人等 | 個人その他 | 計 | |||
| 個人以外 | 個人 | ||||||||
| 株主数 (人) | 0 | 6 | 25 | 153 | 23 | 18 | 5,444 | 5,669 | - |
| 所有株式数(単元) | 0 | 6,567 | 3,902 | 34,768 | 17,689 | 5,692 | 22,145 | 90,763 | 600 |
| 所有株式数の割合(%) | 0 | 7.23 | 4.30 | 38.31 | 19.49 | 6.27 | 24.40 | 100.00 | - |
(7)【大株主の状況】
Section titled “(7)【大株主の状況】”| 平成25年12月31日現在 | |||
| 氏名又は名称 | 住所 | 所有株式数 (株) | 発行済株式総数に対する所有株式数の割合(%) |
| 湘南ソニック1号投資事業有限責任組合 | 神奈川県鎌倉市手広2丁目6-9 | 1,600,000 | 17.63 |
| アステラス製薬株式会社 | 東京都中央区日本橋2丁目5-1号 | 727,200 | 8.01 |
| WONIK CUBE Corp. | WOINK BUILDING 612 SAMPYEONG-DONG, BUNDANG-GU,SEONGNAM-SI, GYEONGGI-DO,KOREA | 712,900 | 7.85 |
| KD PARTNERS CO.,LTD | 8F,EUNTAP B/D,944-29,DAECHI-DONG, GANGNAM-GU,SEOUL,KOREA | 442,300 | 4.87 |
| MIN KON KIM | EUNWHASAM SHINEVILL C-5, 58-6,BAEGOK-DAERO 884 BEON-GIL,CHEOIN-GU, YONGIN-SI,GYEONGGI-DO,KOREA | 411,900 | 4.54 |
| 日本トラスティ・サービス信託銀行株式会社 | 東京都中央区晴海1丁目8-11 | 380,000 | 4.19 |
| CBC株式会社 | 東京都中央区月島2丁目15番13号 | 375,000 | 4.13 |
| 浦田泰生 | 東京都港区六本木1丁目7-24 | 320,700 | 3.53 |
| NVCC6号投資事業有限責任組合 | 東京都港区赤坂7丁目1-16 | 240,000 | 2.64 |
| 日本マスタートラスト信託銀行株式会社 | 東京都港区浜松町2丁目11番3号 | 196,400 | 2.16 |
| 計 | - | 5,406,400 | 59.56 |
(注)前事業年度末において主要株主であったHUNUS Inc.は、平成25年8月23日付で、WONIK CUBE Corp.に社名変更しております。また、HUNUS BIO Inc.は、当事業年度で主要株主ではなくなりました。
(8)【議決権の状況】
Section titled “(8)【議決権の状況】”①【発行済株式】
Section titled “①【発行済株式】”| 平成25年12月31日現在 | |||
| 区分 | 株式数(株) | 議決権の数(個) | 内容 |
| 無議決権株式 | - | - | - |
| 議決権制限株式(自己株式等) | - | - | - |
| 議決権制限株式(その他) | - | - | |
| 完全議決権株式(自己株式等) | - | - | - |
| 完全議決権株式(その他) | 普通株式 9,076,300 | 90,763 | 権利内容に何ら限定のない当社における標準となる株式 |
| 単元未満株式 | 600 | - | - |
| 発行済株式総数 | 9,076,900 | - | - |
| 総株主の議決権 | 9,076,300 | 90,763 | - |
②【自己株式等】
Section titled “②【自己株式等】”該当事項はありません。
(9)【ストック・オプション制度の内容】
Section titled “(9)【ストック・オプション制度の内容】”当社は、ストック・オプション制度を採用しております。当該制度は、旧商法及び会社法に基づき新株予約権を発行する方法によるものであります。当該制度の内容は、以下のとおりであります。
① 平成22年10月26日開催の臨時株主総会決議に基づくもの(第10回新株予約権)
会社法に基づき、下表の付与対象者に対しストック・オプションとして新株予約権を発行することを平成22年10月26日開催の臨時株主総会において特別決議したものであります。
| 決議年月日 | 平成22年10月26日 |
| 付与対象者の区分及び人数(名) | 当社取締役 5 当社監査役 1 当社従業員 12 社外協力者 6 |
| 新株予約権の目的となる株式の種類 | 「(2)新株予約権等の状況」に記載しております。 |
| 株式の数(株) | 同上 |
| 新株予約権の行使時の払込金額(円) | 同上 |
| 新株予約権の行使期間 | 同上 |
| 新株予約権の行使の条件 | 同上 |
| 新株予約権の譲渡に関する事項 | 同上 |
| 代用払込みに関する事項 | 同上 |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | 同上 |
② 平成23年12月6日開催の臨時株主総会決議に基づくもの(第12回新株予約権)
会社法に基づき、下表の付与対象者に対しストック・オプションとして新株予約権を発行することを平成23年12月6日開催の臨時株主総会において特別決議したものであります。
| 決議年月日 | 平成23年12月6日 |
| 付与対象者の区分及び人数(名) | 当社取締役 7 当社監査役 3 当社従業員 9 子会社従業員 6 社外協力者 3 |
| 新株予約権の目的となる株式の種類 | 「(2)新株予約権等の状況」に記載しております。 |
| 株式の数(株) | 同上 |
| 新株予約権の行使時の払込金額(円) | 同上 |
| 新株予約権の行使期間 | 同上 |
| 新株予約権の行使の条件 | 同上 |
| 新株予約権の譲渡に関する事項 | 同上 |
| 代用払込みに関する事項 | 同上 |
| 組織再編成行為に伴う新株予約権の交付に関する事項 | 同上 |
2【自己株式の取得等の状況】
Section titled “2【自己株式の取得等の状況】”【株式の種類等】 会社法第155条第1号によるA種類株式の取得
(1)【株主総会決議による取得の状況】
Section titled “(1)【株主総会決議による取得の状況】”該当事項はありません。
(2)【取締役会決議による取得の状況】
Section titled “(2)【取締役会決議による取得の状況】”該当事項はありません。
(3)【株主総会決議又は取締役会決議に基づかないものの内容】
Section titled “(3)【株主総会決議又は取締役会決議に基づかないものの内容】”会社法第155条第1号によるA種類株式の取得
| 区分 | 株式数(株) | 価額の総額(円) |
| 当事業年度における取得自己株式 | 363,600 | - |
| 当期間における取得自己株式 | - | - |
(4)【取得自己株式の処理状況及び保有状況】
Section titled “(4)【取得自己株式の処理状況及び保有状況】”| 区分 | 当事業年度 | 当期間 | ||
| 株式数(株) | 処分価額の総額 (円) | 株式数(株) | 処分価額の総額 (円) | |
| 消却の処分を行った取得自己株式 | 363,600 | - | - | - |
| 保有自己株式 | - | - | - | - |
3【配当政策】
Section titled “3【配当政策】”当社は、研究開発型ベンチャー企業として、先行投資的な事業資金等を支出してまいりました事により、これまで利益配当を実施しておりません。しかしながら、株主に対する利益還元を重要な経営課題として認識しており、経営基盤の一層の強化と積極的な事業展開に備えた内部留保の充実を勘案しながら、各期の経営成績を考慮に入れて配当政策を決定して参ります。
剰余金の配当を行う場合は、年1回期末を基準日としての配当を考えており、配当の決定機関は株主総会であります。当社は、「取締役会の決議により、毎年6月30日の株主名簿に記載又は記録された株主もしくは登録株式質権者に対し、中間配当を行うことができる。」旨を定款に定めております。
4【株価の推移】
Section titled “4【株価の推移】”(1)【最近5年間の事業年度別最高・最低株価】
Section titled “(1)【最近5年間の事業年度別最高・最低株価】”| 回次 | 第6期 | 第7期 | 第8期 | 第9期 | 第10期 |
| 決算年月 | 平成21年12月 | 平成22年12月 | 平成23年12月 | 平成24年12月 | 平成25年12月 |
| 最高(円) | - | - | - | - | 3,750 |
| 最低(円) | - | - | - | - | 2,607 |
(注) 最高・最低株価は、東京証券取引所マザーズにおけるものであります。
なお、平成25年12月6日付をもって同取引所に株式を上場いたしましたので、それ以前の株価については該当事項はありません。
(2)【最近6月間の月別最高・最低株価】
Section titled “(2)【最近6月間の月別最高・最低株価】”| 月別 | 平成25年7月 | 8月 | 9月 | 10月 | 11月 | 12月 |
| 最高(円) | - | - | - | - | - | 3,750 |
| 最低(円) | - | - | - | - | - | 2,607 |
(注) 最高・最低株価は、東京証券取引所マザーズにおけるものであります。
なお、平成25年12月6日付をもって同取引所に株式を上場いたしましたので、それ以前の株価については該当事項はありません。
5【役員の状況】
Section titled “5【役員の状況】”| 役名 | 職名 | 氏名 | 生年月日 | 略歴 | 任期 | 所有 株式数 (株) | |
| 代表取締役社長 | - | 浦田 泰生 | 昭和30年10月26日生 | 昭和58年4月 平成6年8月 平成14年3月 平成15年8月 平成16年3月 平成21年11月 | 小野薬品工業株式会社入社 日本たばこ産業株式会社入社 同 研究開発企画部長就任 同 医薬事業部調査役就任 当社設立 当社代表取締役社長就任(現任) バイオ・イノベーション研究会(経済産業省)委員就任 | 注 3 | 320,700 |
| 取締役 | 経理部長 | 六反田 靖 | 昭和39年8月29日生 | 昭和62年4月 平成4年2月 平成12年4月 平成18年7月 平成18年10月 平成19年3月 平成24年4月 | 住友生命相互会社入社 株式会社ベンチャーリンク入社 ユニバーサルソリューションシステムズ株式会社入社 同 取締役管理部長就任 当社入社 当社業務管理部長就任 当社取締役就任(現任) 当社経理部長就任(現任) | 注 3 | 85,500 |
| 取締役 | 事業開発部長 | 樫原 康成 | 昭和40年12月8日生 | 平成3年4月 平成9年1月 平成14年8月 平成17年2月 平成19年12月 平成20年3月 平成20年4月 | 日本チバガイギー株式会社入社 参天製薬株式会社入社 Trinity College Dublin留学、MBA 株式会社UMNファーマ入社 同 代表取締役社長就任 当社入社 経営企画部長就任 当社取締役就任(現任) 当社事業開発部長就任(現任) | 注 3 | 77,500 |
| 取締役 | - | 吉村 圭司 | 昭和30年7月14日 | 昭和54年4月 昭和60年4月 平成5年11月 平成15年10月 平成19年11月 平成25年3月 | クーパース アンド ライブランド 入社 ICIジャパン 入社 アムジェン株式会社入社 同 財務・法務・IT部長就任 株式会社ゴーセン入社 同 取締役専務執行役員就任 大興製紙株式会社入社 同 取締役CFO 就任 当社取締役就任(現任) | 注 3 | - |
| 役名 | 職名 | 氏名 | 生年月日 | 略歴 | 任期 | 所有 株式数 (株) | |
| 取締役 | - | 浦野 文男 | 昭和18年4月12日生 | 昭和43年4月 平成元年6月 平成12年6月 平成19年4月 平成20年8月 平成21年3月 平成25年3月 | 旭光学工業株式会社(後:ペンタックス株式会社)入社 同社取締役就任 同社代表取締役社長就任 HOYA株式会社顧問就任 株式会社エクスキャリバー代表取締役就任(現任) TeraRecon,Inc.(米国)社外取締役就任(現任) 当社取締役就任(現任) | 注 3 | - |
| 監査役 (常勤) | - | 森本 兀 | 昭和20年6月18日生 | 昭和44年4月 昭和48年9月 平成3年6月 平成11年10月 平成13年6月 平成19年11月 平成20年11月 | 関東道路株式会社入社 アトム化学塗料株式会社(現 アトミクス株式会社)入社 同 取締役就任 アトム商事株式会社(現 アトムサポート株式会社) 代表取締役社長就任 アトミクス株式会社 常勤監査役就任 日本監査役協会理事就任 当社常勤監査役就任(現任) | 注 4 | - |
| 監査役 | - | 上野 健二郎 | 昭和14年1月1日生 | 昭和36年4月 昭和41年4月 昭和62年4月 平成13年7月 平成17年6月 平成19年6月 平成25年3月 | 昭和電工株式会社入社 弁護士登録 日本弁護士連合会常務理事 最高裁判所公平委員会委員長(現任) セイノーホールディングス株式会社社外取締役就任(現任) 王子ホールディングス株式会社社外監査役就任(現任) 当社監査役就任(現任) | 注 4 | - |
| 監査役 | - | 大木 史郎 | 昭和18年9月13日生 | 昭和45年4月 平成11年1月 平成17年9月 平成19年3月 平成21年9月 平成23年9月 | 小野薬品工業株式会社入社 日本たばこ産業株式会社入社 同社執行役員臨床開発部長就任 富士化学工業株式会社入社 同社開発部長就任 当社監査役就任 当社監査役退任 当社監査役就任(現任) | 注 4 | 10,000 |
| 計 | 439,700 | ||||||
(注)1.取締役浦野文男は、社外取締役であります。
2.監査役の上野健二郎及び大木史郎は、社外監査役であります。
3.平成25年3月27日開催の定時株主総会の終結の時から平成26年12月期に係る定時株主総会の終結の時までであり
ます。
4.平成25年3月27日開催の定時株主総会の終結の時から平成28年12月期に係る定時株主総会の終結の時までであり
ます。
5.当社は、法令に定める監査役を欠くことになる場合に備え、会社法第329条第2項に定める補欠監査役1名を選任しております。補欠監査役の略歴は次のとおりであります。
| 氏名 | 生年月日 | 略歴 | 所有株式数 (千株) |
| 山岡 通弘 | 昭和41年9月12日 | 平成6年4月 弁護士登録 平成19年4月 慶應義塾大学大学院法務研究科准教授 平成20年6月 株式会社岡本工作機械製作所 社外監査役(現任) 平成23年4月 司法研修所刑事弁護教官(現任) | - |
6【コーポレート・ガバナンスの状況等】
Section titled “6【コーポレート・ガバナンスの状況等】”(1)【コーポレート・ガバナンスの状況】
Section titled “(1)【コーポレート・ガバナンスの状況】”① コーポレート・ガバナンスに関する基本的な考え方
当社は、経営が効率性と適法性を同時に確保しつつ、健全に発展するために、コーポレート・ガバナンスが有効に機能することが不可欠であるとの認識のもと、その目的である「経営に対する監視機能」「研究開発を基盤とした効率的経営による収益体制の強化」「経営内容の健全性」を実現するとともに、経営上の重要課題と考えております。
② 企業統治の体制
イ.企業統治の体制の概要
当社は、取締役会、監査役会及び会計監査人設置会社であります。
当社の企業統治の体制における各機関の内容は以下の通りであります。
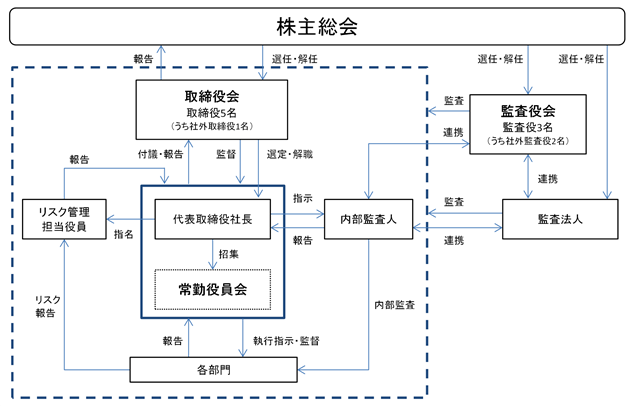
(取締役会)
当社の取締役会は、5名の取締役で構成され、月1回定期的に開催するほか必要に応じ臨時的に開催しております。取締役会においては、戦略的かつスピーディな経営を実現し、競争力の維持・強化をするために、経営の意思決定と業務執行の監督及び会社法に基づく決議事項について、積極的な議論のうえに決定することを旨としております。また、経営者として豊かな経験と実績を有する人財を社外取締役に起用する事により、事業の拡大発展、着実な企業価値向上に向けて適切な意思決定を行う事のできる仕組みを構築しております。
(常勤役員会)
常勤役員会は、常勤取締役により構成され、原則として毎週1回開催され、必要に応じ臨時的に開催して
おります。機能としましては、取締役会の決定した経営基本方針に基づき、経営に関する重要な事項の審
議・決裁を行うことにより、機動的な経営判断・業務執行に関する意思決定を実現し、取締役会を補佐す
る機能を有する機関として設置しております。
(監査役会)
当社は経営の適法性や効率性について総合的に監査する機関として監査役会を設置しており、常勤監査役1名及び非常勤監査役2名(社外監査役)を選任しております。監査役会は、毎月1回定例の監査役会を開催するほか、必要に応じて臨時の監査役会を開催しております。同会において、監査方針及び監査計画に従って行われる取締役の業務執行状況等に関する監査内容について、確認及び協議を行っております。また、内部監査人及び会計監査人とも連携し、監査の有効性ならびに効率性を高めております。各監査役は、監査役会が定めた監査方針・監査計画及び監査業務の分担に従い、取締役会等の会社の重要な会議に出席し、重要な事項等について報告を行うとともに意見を述べております。
(リスク管理担当役員)
当社は、「リスク管理規程」に基づき取締役1名をリスク管理担当役員に任命しております。リスク管理担当役員は、他の常勤取締役・監査役・内部監査人と密な連携をとって事業遂行上のリスクについて集約・棚卸・評価・対応要請を行っております。また必要に応じ、経営財務会議にリスクの対応審議を上程しております。
(内部監査人)
当社は、内部統制の有効性及び業務の遂行状況を監査するために代表取締役社長直轄で他部署から独立した内部監査人を設置しております。内部監査人は、全部門の監査を行うと共に、法令・社内諸規則の遵守やリスクの予防の状況を検証しております。また、内部監査指摘事項の改善状況を定期的に確認するとともに、リスク管理担当役員とも連携し、会社業績向上・業務の効率性改善・業務の適法性の維持に努めております。
ロ.内部統制システムの整備の状況
内部統制システムにおいて、内部監査は重要な役割であることを認識しており、代表取締役直属の独立した内部監査人が、監査役及び会計監査人との連携のもと計画的な内部監査を全部署に対して実施しております。また、当社は、「業務分掌規程」「職務権限規程」「決議規程」等の社内規程を制定し、役職員の権限と責任の所在を明確にし、内部統制システムがその機能の有効性を維持できる体制を整備しております。なお、社内規程については、必要に応じ適宜改定を行っております。
ハ.リスク管理体制の整備状況
当社のリスク管理体制は、リスク管理担当役員が中心となり常勤取締役・監査役・内部監査人・各部門責任者と密な連携をとりながら必要に応じて経営財務会議等で協議し、その対応を決定しております。
また、顧問弁護士事務所、弁理士、税理士、社会保険労務士等より、経営全般にわたっての助言を受けております。
ニ.責任限定契約の内容の概要
当社と社外取締役及び各社外監査役は、会社法第427条第1項の規定に基づき、同法第423条第1項の損害賠償責任を限定する契約を締結しております。当該契約に基づく損害賠償責任の限度額は、法令が規定する額としております。
③ 内部監査及び監査役監査の状況
当社の内部監査及び監査役監査は、内部監査人及び監査役がそれぞれ行っております。
内部監査人は、内部統制の有効性及び業務の遂行状況を監査するために代表取締役社長直轄で他部署から独立した担当者1名が行う体制としております。内部監査人は、毎期計画的に各部門の業務の遂行状況について監査を行うと共に、法令・社内諸規則の遵守やリスクの予防の状況を検証しております。また、内部監査指摘事項の改善状況を定期的に確認するとともに、リスク管理担当役員とも連携し、会社業績向上・業務の効率性改善・業務の適法性の維持に努めております。
各監査役は毎月1回開催されております監査役会に出席するとともに、常勤監査役は、取締役会その他重要な会議に出席し、または必要に応じて代表取締役社長との面談を行い、経営全般に関する意見具申を行っております。さらに取締役並びに内部監査人及び現場責任者の履行改善状況を確認し、管理体制についての助言・指導を行っております。
なお、常勤監査役森本兀は企業の管理部門並びに取締役及び監査役を歴任し、日本監査役協会の理事を務めた経験もあり会社経営並びに監査役監査に対する相当程度の知見を有しております。
監査役(社外監査役含む)は、会計監査人との関係において、法令に基づき会計監査報告を受領し、相当性についての監査を行うとともに、必要の都度相互に情報交換・意見交換を行うなどの連携を行い、内部監査部門との関係においても、内部監査の計画及び結果についての報告を受けることで、監査役監査の実効性と効率性の向上を目指しています。
各部門は、内部統制の整備・運用状況等に関して、内部監査部門、監査役及び会計監査人に対し、必要に応じて報告を行っています。
④ 会計監査の状況
当社は、新日本有限責任監査法人の会計監査を受けております。平成25年12月期における当社の監査体制は、以下のとおりです。なお当社と同監査法人及び業務執行社員との間には、公認会計士法の定めによる特別な利害関係はありません。
会計監査業務を執行した公認会計士並びに補助者:
監査責任者
指定有限責任社員・業務執行社員 稲垣正人(当社に係る継続監査年数は7年以内です。)
指定有限責任社員・業務執行社員 上林礼子(当社に係る継続監査年数は7年以内です。)
監査補助者
公認会計士 12名
その他 4名
⑤ 社外役員の状況
当社は社外取締役に浦野文男を選任しております。当社は、経営の意思決定機能と業務執行機能を有する取締役会に対し、社外取締役の設置、監査役3名中の2名を社外監査役とすることで経営への監視機能を強化しております。コーポレート・ガバナンスにおいて、外部からの客観的、中立の経営監視の機能が重要と考えており、社外監査役2名の監査が実施される事により、外部からの経営監視機能が十分に機能する体制が整っているため、現状の体制としております。
社外取締役の浦野文男は、上場企業の代表取締役を経験されており、経営についての相当程度の知見を有しております。
社外監査役上野健二郎は弁護士であり、法務並びにコンプライアンスに対する相当程度の知見を有しております。社外監査役大木史郎は長年製薬企業で研究開発の責任者を務めており、当社事業に対する相当程度の知見を有しております。また、当社の株式を10,000株保有しております。
当社は、社外監査役大木史郎に新株予約権75個を付与しております。その他、人的関係、利害関係はありません。
社外監査役の選任においては十分な専門性をもって常勤監査役の知見を補い、当社の取締役の意思決定及び業務執行を監視し、取締役・内部監査人及び現場責任者に対して有用な助言等を行える知見を有していることを重視しております。
⑥ 社外取締役及び社外監査役が企業統治において果たす機能及び役割並びに当該社外取締役又は社外監査役を
選任するための当社からの独立性に関する基準又は方針の内容
当社は、社外取締役又は社外監査役を選任するための独立性に関する基準又は方針として明確に定めたものは
ありませんが、その選任に際しては、経歴や当社との関係を踏まえて、当社経営陣から独立した立場で社外役員
としての職務を遂行できる十分な独立性が確保できることを個別に判断しております。また、それぞれの職務で
の豊富な経験・知識に基づく視点を生かし、客観的・中立的な立場から経営の監視と助言を行うことができる
人財を選任しております。
社外取締役は、上場企業の代表取締役を経験されており豊富な経験で培われた知識を企業経営全般に活かし、
取締役会の透明性の向上及び監督機能の強化のため、独立性をもって経営の監視と助言を行うことが期待できる
ものと考えております。
また、社外監査役は、独立した立場からそれぞれの豊富な経験・知見を生かし、取締役会において積極的に
発言することで経営の監視機能を果たしており、他の監査役、内部監査室、会計監査人等と連携し、経営監視
機能の充実に努めております。
⑦ 役員報酬等
イ.役員区分ごとの報酬等の総額、報酬等の種類別の総額及び対象となる役員の員数
| 対象となる役員の員数(人) | 報酬等の総額 (千円) | 報酬等の種類別の総額(千円) | |||
| 基本報酬 | 賞与 | ストック・オプション | |||
| 取締役(社外取締役除く) | 8 | 82,316 | 72,316 | 10,000 | - |
| 監査役(社外監査役除く) | 1 | 6,900 | 6,600 | 300 | - |
| 社外役員 | 4 | 6,796 | 6,796 | - | - |
| 合計 | 13 | 96,013 | 85,713 | 10,300 | - |
ロ.役員の報酬の額又はその算定方法の決定に関する方針の内容及び決定方法
当社の役員報酬等の額又はその算定方法の決定に関する方針は、株主総会で承認された範囲内において、取締役会で個別の額の決定を行うものであります。
⑧ 取締役の定数
当社の取締役は8名以内とする旨を定款で定めております。
⑨ 取締役の選任の決議要件
当社は、取締役の選任決議について、議決権を行使することができる株主の議決権の3分の1以上を有する株主が出席し、その議決権の過半数をもって行い、累積投票によらない旨を定款で定めております。
⑩ 取締役及び監査役の責任免除
当社は、取締役及び監査役が職務の遂行にあたり期待される役割を十分に発揮できるよう、会社法第426条第1項の規定により、任務を怠ったことによる取締役(取締役であった者を含む。)及び監査役(監査役であった者を含む。)の損害賠償責任を、法令の限度において、取締役会の決議によって免除することができる旨を定款に定めております。
⑪ 中間配当
当社は、株主への機動的な利益還元を目的として、取締役会の決議によって、毎年6月30日の最終の株主名簿に記載又は記録された株主若しくは登録株式質権者に対し、中間配当を行うことができる旨を定款に定めております。
⑫ 自己株式の取得
当社は、経営環境の変化に対応した機動的な資本政策の遂行を可能とするため、取締役会の決議によって、市場取引等により自己株式を取得する事ができる旨を定款に定めております。
⑬ 株主総会の特別決議要件の変更
当社は、株主総会の円滑な運営を行うため、会社法第309条第2項に定める株主総会の特別決議要件について、議決権を行使することができる株主の議決権の3分の1以上を有する株主が出席し、その議決権の3分の2以上をもって行う旨を定款に定めております。
⑭ 株式の保有状況
イ.投資株式のうち保有目的が純投資目的以外の目的であるものの銘柄数及び貸借対照表計上額の合計額
1銘柄 14,274千円
ロ.保有目的が純投資目的以外の目的である投資株式の保有区分、銘柄、株式数、貸借対照表計上額及び保有目的
前事業年度
特定投資株式
| 銘柄 | 株式数(株) | 貸借対照表計上額 (千円) | 保有目的 |
| Benitec Biopharma,Ltd. | 6,656,717 | 8,366 | 事業関係の安定化 |
当事業年度
特定投資株式
| 銘柄 | 株式数(株) | 貸借対照表計上額 (千円) | 保有目的 |
| Benitec Biopharma,Ltd. | 266,270 | 14,274 | 事業関係の安定化 |
(2)【監査報酬の内容等】
Section titled “(2)【監査報酬の内容等】”①【監査公認会計士等に対する報酬の内容】
Section titled “①【監査公認会計士等に対する報酬の内容】”| 区分 | 前事業年度 | 当事業年度 | ||
| 監査証明業務に基づく報酬(千円) | 非監査業務に基づく報酬(千円) | 監査証明業務に基づく報酬(千円) | 非監査業務に基づく報酬(千円) | |
| 提出会社 | 18,400 | - | 17,000 | 1,000 |
②【その他重要な報酬の内容】
Section titled “②【その他重要な報酬の内容】”該当事項はありません。
③【監査公認会計士等の提出会社に対する非監査業務の内容】
Section titled “③【監査公認会計士等の提出会社に対する非監査業務の内容】”前事業年度
該当事項はありません。
当事業年度
当社が監査公認会計士等に対して報酬を支払っている非監査業務の内容は、上場株式の売出に伴うコンフォートレター作成であります。
④【監査報酬の決定方針】
Section titled “④【監査報酬の決定方針】”当社は、監査報酬の決定方針を特に定めておりませんが、監査計画、監査体制と日程、事業規模、業態等を勘案し、会計監査人と検討した上で決定しております。
第5【経理の状況】
Section titled “第5【経理の状況】”1.財務諸表の作成方法について
当社の財務諸表は、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づいて作成しております。
2.監査証明について
当社は、金融商品取引法第193条の2第1項の規定に基づき、事業年度(平成25年1月1日から平成25年12月31日まで)の財務諸表について、新日本有限責任監査法人により監査を受けております。
3.連結財務諸表について
当社は子会社がありませんので、連結財務諸表を作成しておりません。
4.財務諸表等の適正性を確保するための特段の取組みについて
当社は、財務諸表等の適正性を確保するための特段の取組みを行っております。具体的には、会計基準等の内容を適切に把握し、または会計基準等の変更等について的確に対応することができる体制を整備するため、監査法人等が主催する研修に参加しています。
1【財務諸表等】
Section titled “1【財務諸表等】”(1)【財務諸表】
Section titled “(1)【財務諸表】”①【貸借対照表】
Section titled “①【貸借対照表】”| (単位:千円) | ||
| 前事業年度 (平成24年12月31日) | 当事業年度 (平成25年12月31日) | |
| 資産の部 | ||
| 流動資産 | ||
| 現金及び預金 | ※1 696,975 | ※1 5,579,610 |
| 売掛金 | - | 1,000 |
| 製品 | 14,936 | 19,523 |
| 貯蔵品 | 3,115 | 2,090 |
| 前払金 | - | 10,228 |
| 前払費用 | 5,521 | 4,653 |
| 未収入金 | 2,464 | 1,318 |
| 未収消費税等 | 7,472 | 12,609 |
| その他 | 225 | 212 |
| 流動資産合計 | 730,711 | 5,631,246 |
| 固定資産 | ||
| 有形固定資産 | ||
| 建物 | 22,104 | 22,104 |
| 減価償却累計額 | △10,356 | △11,916 |
| 建物(純額) | 11,747 | 10,187 |
| 機械及び装置 | 37,761 | 29,870 |
| 減価償却累計額 | △26,274 | △29,870 |
| 機械及び装置(純額) | 11,486 | - |
| 工具、器具及び備品 | 58,409 | 71,603 |
| 減価償却累計額 | △36,141 | △45,939 |
| 工具、器具及び備品(純額) | 22,267 | 25,664 |
| 有形固定資産合計 | 45,502 | 35,852 |
| 無形固定資産 | ||
| ソフトウエア | 1,669 | 1,261 |
| 無形固定資産合計 | 1,669 | 1,261 |
| 投資その他の資産 | ||
| 投資有価証券 | 8,366 | 14,274 |
| 出資金 | 100 | 100 |
| 敷金及び保証金 | 13,200 | 13,899 |
| その他 | 816 | 18 |
| 投資その他の資産合計 | 22,483 | 28,291 |
| 固定資産合計 | 69,654 | 65,404 |
| 資産合計 | 800,366 | 5,696,651 |
| (単位:千円) | ||
| 前事業年度 (平成24年12月31日) | 当事業年度 (平成25年12月31日) | |
| 負債の部 | ||
| 流動負債 | ||
| 短期借入金 | ※1 61,500 | ※1 154,672 |
| リース債務 | 2,160 | 5,055 |
| 未払金 | 10,098 | 36,570 |
| 未払費用 | 6,179 | 9,688 |
| 未払法人税等 | 7,820 | 18,359 |
| 預り金 | 2,962 | 8,582 |
| 流動負債合計 | 90,722 | 232,928 |
| 固定負債 | ||
| 長期借入金 | 222,000 | 343,328 |
| リース債務 | 6,218 | 15,194 |
| 退職給付引当金 | 1,585 | 2,115 |
| 資産除去債務 | 5,979 | 6,074 |
| 繰延税金負債 | 1,386 | 3,352 |
| 固定負債合計 | 237,169 | 370,063 |
| 負債合計 | 327,891 | 602,992 |
| 純資産の部 | ||
| 株主資本 | ||
| 資本金 | 2,442,980 | 5,059,448 |
| 新株式申込証拠金 | - | 20,000 |
| 資本剰余金 | ||
| 資本準備金 | 2,435,480 | 5,051,948 |
| 資本剰余金合計 | 2,435,480 | 5,051,948 |
| 利益剰余金 | ||
| その他利益剰余金 | ||
| 繰越利益剰余金 | △4,406,071 | △5,041,625 |
| 利益剰余金合計 | △4,406,071 | △5,041,625 |
| 株主資本合計 | 472,388 | 5,089,770 |
| 評価・換算差額等 | ||
| その他有価証券評価差額金 | 86 | 3,888 |
| 評価・換算差額等合計 | 86 | 3,888 |
| 純資産合計 | 472,474 | 5,093,658 |
| 負債純資産合計 | 800,366 | 5,696,651 |
②【損益計算書】
Section titled “②【損益計算書】”| (単位:千円) | ||
| 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | |
| 売上高 | 396,754 | 1,180 |
| 売上原価 | ||
| 製品期首たな卸高 | 12,740 | 14,936 |
| 当期製品製造原価 | - | 4,789 |
| 合併による製品受入高 | 2,336 | - |
| 合計 | 15,076 | 19,725 |
| 他勘定振替高 | ※1 140 | ※1 161 |
| 製品期末たな卸高 | 14,936 | 19,523 |
| 製品売上原価 | - | 40 |
| 売上総利益 | 396,754 | 1,139 |
| 販売費及び一般管理費 | ※2,※3 537,709 | ※2,※3 666,601 |
| 営業損失(△) | △140,954 | △665,462 |
| 営業外収益 | ||
| 受取利息 | ※4 958 | 883 |
| 受取配当金 | 5,172 | 4 |
| 助成金収入 | 1,030 | 15,801 |
| 受取研究開発負担金 | - | 21,280 |
| 受取補償金 | - | 4,071 |
| 為替差益 | 42,343 | 42,206 |
| その他 | ※4 6,131 | 16 |
| 営業外収益合計 | 55,635 | 84,262 |
| 営業外費用 | ||
| 支払利息 | 8,345 | 2,839 |
| 支払保証料 | - | 422 |
| 支払家賃 | 3,060 | - |
| 株式交付費 | 894 | 39,681 |
| その他 | 1,191 | 1,159 |
| 営業外費用合計 | 13,491 | 44,102 |
| 経常損失(△) | △98,810 | △625,302 |
| 特別利益 | ||
| 固定資産売却益 | 51 | - |
| ライセンス解約一時金 | 5,990 | - |
| 貸倒引当金戻入額 | 69,142 | - |
| 特別利益合計 | 75,183 | - |
| 特別損失 | ||
| 減損損失 | - | ※6 7,891 |
| 抱合せ株式消滅差損 | ※5 66,093 | - |
| 投資有価証券売却損 | 8,245 | - |
| 投資有価証券評価損 | 2,547 | - |
| 特別損失合計 | 76,886 | 7,891 |
| 税引前当期純損失(△) | △100,513 | △633,193 |
| 法人税、住民税及び事業税 | 2,465 | 2,500 |
| 法人税等調整額 | △149 | △140 |
| 法人税等合計 | 2,315 | 2,359 |
| 当期純損失(△) | △102,829 | △635,553 |
③【製造原価明細書】
| 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | ||||
| 区分 | 注記番号 | 金額(千円) | 構成比 (%) | 金額(千円) | 構成比 (%) |
| Ⅰ 材料費 | - | 1,110 | 23.2 | ||
| Ⅱ 労務費 | - | 1,548 | 32.3 | ||
| Ⅲ 経費 | ※1 | - | 2,129 | 44.5 | |
| 当期総製造費用 | - | 4,789 | 100.0 | ||
| 期首仕掛品たな卸高 | - | - | |||
| 他勘定受入高 | - | - | |||
| 合計 | - | 4,789 | |||
| 期末仕掛品たな卸高 | - | - | |||
| 他勘定振替高 | - | - | |||
| 当期製品製造原価 | - | 4,789 |
原価計算の方法
原価計算の方法は、製品別個別原価計算によっております。
(注)※1. 主な内訳は次のとおりです。
| 項目 | 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) |
| 間接労務費(千円) | - | 654 |
| 地代家賃(千円) | - | 626 |
| 減価償却費(千円) | - | 556 |
④【株主資本等変動計算書】
Section titled “④【株主資本等変動計算書】”前事業年度(自 平成24年1月1日 至 平成24年12月31日)
| (単位:千円) | ||||||
| 株主資本 | ||||||
| 資本金 | 資本剰余金 | 利益剰余金 | 株主資本合計 | |||
| 資本準備金 | 資本剰余金合計 | その他利益剰余金 | 利益剰余金合計 | |||
| 繰越利益剰余金 | ||||||
| 当期首残高 | 2,314,580 | 2,307,080 | 2,307,080 | △4,303,242 | △4,303,242 | 318,417 |
| 当期変動額 | ||||||
| 新株の発行 | 128,400 | 128,400 | 128,400 | - | - | 256,800 |
| 当期純損失(△) | - | - | - | △102,829 | △102,829 | △102,829 |
| 株主資本以外の項目の当期変動額(純額) | - | - | - | - | - | - |
| 当期変動額合計 | 128,400 | 128,400 | 128,400 | △102,829 | △102,829 | 153,970 |
| 当期末残高 | 2,442,980 | 2,435,480 | 2,435,480 | △4,406,071 | △4,406,071 | 472,388 |
| 評価・換算差額等 | 純資産合計 | ||
| その他有価証券評価差額金 | 評価・換算差額等合計 | ||
| 当期首残高 | △8,632 | △8,632 | 309,785 |
| 当期変動額 | |||
| 新株の発行 | - | - | 256,800 |
| 当期純損失(△) | - | - | △102,829 |
| 株主資本以外の項目の当期変動額(純額) | 8,718 | 8,718 | 8,718 |
| 当期変動額合計 | 8,718 | 8,718 | 162,689 |
| 当期末残高 | 86 | 86 | 472,474 |
当事業年度(自 平成25年1月1日 至 平成25年12月31日)
| (単位:千円) | |||||||
| 株主資本 | |||||||
| 資本金 | 新株式申込証拠金 | 資本剰余金 | 利益剰余金 | 株主資本合計 | |||
| 資本準備金 | 資本剰余金合計 | その他利益剰余金 | 利益剰余金合計 | ||||
| 繰越利益剰余金 | |||||||
| 当期首残高 | 2,442,980 | - | 2,435,480 | 2,435,480 | △4,406,071 | △4,406,071 | 472,388 |
| 当期変動額 | |||||||
| 新株の発行 | 2,616,468 | - | 2,616,468 | 2,616,468 | - | - | 5,232,936 |
| 新株式申込証拠金の払込 | - | 20,000 | - | - | - | - | 20,000 |
| 当期純損失(△) | - | - | - | - | △635,553 | △635,553 | △635,553 |
| 株主資本以外の項目の当期変動額(純額) | - | - | - | - | - | - | - |
| 当期変動額合計 | 2,616,468 | 20,000 | 2,616,468 | 2,616,468 | △635,553 | △635,553 | 4,617,382 |
| 当期末残高 | 5,059,448 | 20,000 | 5,051,948 | 5,051,948 | △5,041,625 | △5,041,625 | 5,089,770 |
| 評価・換算差額等 | 純資産合計 | ||
| その他有価証券評価差額金 | 評価・換算差額等合計 | ||
| 当期首残高 | 86 | 86 | 472,474 |
| 当期変動額 | |||
| 新株の発行 | - | - | 5,232,936 |
| 新株式申込証拠金の払込 | - | - | 20,000 |
| 当期純損失(△) | - | - | △635,553 |
| 株主資本以外の項目の当期変動額(純額) | 3,801 | 3,801 | 3,801 |
| 当期変動額合計 | 3,801 | 3,801 | 4,621,184 |
| 当期末残高 | 3,888 | 3,888 | 5,093,658 |
⑤【キャッシュ・フロー計算書】
Section titled “⑤【キャッシュ・フロー計算書】”| (単位:千円) | ||
| 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | |
| 営業活動によるキャッシュ・フロー | ||
| 税引前当期純損失(△) | △100,513 | △633,193 |
| 減価償却費 | 16,953 | 17,139 |
| 減損損失 | - | 7,891 |
| 退職給付引当金の増減額(△は減少) | 342 | 530 |
| 貸倒引当金の増減額(△は減少) | △69,249 | - |
| 抱合せ株式消滅差損益(△は益) | 66,093 | - |
| 受取利息及び受取配当金 | △6,130 | △887 |
| 支払利息 | 8,345 | 2,839 |
| 株式交付費 | 894 | 39,681 |
| 為替差損益(△は益) | △31,452 | △42,761 |
| ライセンス解約一時金 | △5,990 | - |
| 売上債権の増減額(△は増加) | - | △1,000 |
| たな卸資産の増減額(△は増加) | 795 | △3,561 |
| 未収入金の増減額(△は増加) | △1,667 | 1,146 |
| 未払金の増減額(△は減少) | △38,097 | 11,729 |
| その他 | 7,135 | 5,978 |
| 小計 | △152,541 | △594,468 |
| 利息及び配当金の受取額 | 6,137 | 887 |
| 利息の支払額 | △8,273 | △2,976 |
| ライセンス解約一時金の受取額 | 5,990 | - |
| 法人税等の支払額 | △2,662 | △1,971 |
| 営業活動によるキャッシュ・フロー | △151,349 | △598,528 |
| 投資活動によるキャッシュ・フロー | ||
| 定期預金の預入による支出 | △417,120 | △75,000 |
| 定期預金の払戻による収入 | 170,700 | 187,138 |
| 投資有価証券の売却による収入 | 2,179 | - |
| 有形固定資産の取得による支出 | △15,374 | △678 |
| 有形固定資産の売却による収入 | 140 | - |
| 貸付けによる支出 | △11,000 | - |
| 敷金及び保証金の差入による支出 | △2,351 | △1,002 |
| 敷金及び保証金の回収による収入 | 1,472 | - |
| 投資活動によるキャッシュ・フロー | △271,354 | 110,458 |
| 財務活動によるキャッシュ・フロー | ||
| 短期借入金の純増減額(△は減少) | △19,500 | 77,500 |
| 長期借入れによる収入 | 130,000 | 165,000 |
| 長期借入金の返済による支出 | △2,000 | △28,000 |
| リース債務の返済による支出 | △1,953 | △2,329 |
| 株式の発行による収入 | 255,905 | 5,232,936 |
| 新株式申込証拠金の払込による収入 | - | 20,000 |
| 株式の発行による支出 | - | △25,024 |
| 財務活動によるキャッシュ・フロー | 362,451 | 5,440,081 |
| 現金及び現金同等物に係る換算差額 | 1,440 | 28,743 |
| 現金及び現金同等物の増減額(△は減少) | △58,811 | 4,980,755 |
| 現金及び現金同等物の期首残高 | 478,808 | 423,855 |
| 連結子会社の合併による現金及び現金同等物の増減額(△は減少) | 3,858 | - |
| 現金及び現金同等物の期末残高 | ※1 423,855 | ※1 5,404,610 |
【注記事項】
Section titled “【注記事項】”(重要な会計方針)
Section titled “(重要な会計方針)”1.有価証券の評価基準及び評価方法
その他有価証券
時価のあるもの
決算日の市場価格等に基づく時価法(評価差額は全部純資産直入法により処理し、売却原価は移動平均法により算定)
2.たな卸資産の評価基準及び評価方法
製品
個別法による原価法(貸借対照表価額については収益性の低下に基づく簿価切り下げの方法により算定)
貯蔵品
個別法による原価法(貸借対照表価額については収益性の低下に基づく簿価切り下げの方法により算定)
3.固定資産の減価償却の方法
(1)有形固定資産(リース資産を除く)
定率法(ただし、建物(付属設備を除く)については定額法)
なお、主な耐用年数は以下の通りであります。
建物 3~15年
機械及び装置 8年
工具、器具及び備品 3~6年
(2) 無形固定資産(リース資産を除く)
定額法
なお、自社利用のソフトウェアについては社内における利用可能期間(5年)に基づく定額法
(3) リース資産
リース期間を耐用年数とし、残存価額を零とする定額法
4.繰延資産の処理方法
株式交付費
支出時に全額費用処理しております。
5.外貨建の資産及び負債の本邦通貨への換算基準
外貨建金銭債権債務は、期末日の直物為替相場により円貨に換算し、換算差額は損益として処理しております。
6.引当金の計上基準
(1)貸倒引当金
債権の貸倒れによる損失に備えるため、一般債権については貸倒実績率により、貸倒懸念債権等特定の債権については個別に回収可能性を勘案し、回収不能見込額を計上しております。
(2)退職給付引当金
従業員の退職給付に備えるため、当事業年度末における退職給付債務の見込額に基づき計上しております。
なお、「退職給付会計に関する実務指針(中間報告)」(日本公認会計士協会 会計制度委員会報告第13号)に定める簡便法を採用しております。
7.キャッシュ・フロー計算書における資金の範囲
手許現金、随時引き出し可能な預金及び容易に換金可能であり、かつ、価値の変動について僅少なリスクしか負わない取得日から3ヶ月以内に償還期限の到来する短期投資からなっております。
8.その他財務諸表作成のための基本となる重要な事項
消費税等の会計処理
消費税等の会計処理は、税抜方式を採用しております。
(会計方針の変更)
Section titled “(会計方針の変更)”(会計上の見積りの変更と区別することが困難な会計方針の変更)
当社は、法人税法の改正に伴い、当事業年度より、平成25年1月1日以後に取得した有形固定資産につい
て、改正後の法人税法に基づく減価償却方法に変更しております。
これによる当事業年度の損益に与える影響は軽微であります。
(表示方法の変更)
Section titled “(表示方法の変更)”(キャッシュ・フロー計算書)
前事業年度において、「営業活動によるキャッシュ・フロー」の「その他」に含めていた「株式交付費」は、金額的重要性が増したため、当事業年度より独立掲記することと致しました。この表示方法の変更を反映させるため、前事業年度の財務諸表の組替を行っております。
この結果、前事業年度のキャッシュ・フロー計算書において、「営業活動によるキャッシュ・フロー」の「その他」に表示していた8,029千円は、「株式交付費」894千円、「その他」7,135千円として組み替えております。
(貸借対照表関係)
Section titled “(貸借対照表関係)”※1 担保資産及び担保付債務
担保に供している資産は以下の通りであります。
| 前事業年度 (平成24年12月31日) | 当事業年度 (平成25年12月31日) | |
| 現金及び預金(定期預金) | 100,000千円 | 100,000千円 |
| 計 | 100,000 | 100,000 |
担保付債務は以下の通りであります。
| 前事業年度 (平成24年12月31日) | 当事業年度 (平成25年12月31日) | |
| 短期借入金 | 10,000千円 | 10,000千円 |
| 計 | 10,000 | 10,000 |
(損益計算書関係)
Section titled “(損益計算書関係)”※1.他勘定振替高の内訳は次の通りであります。
| 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | |
| 研究開発費 | 140千円 | 161千円 |
※2.販売費に属する費用のおおよその割合は前事業年度46%、当事業年度45%、一般管理費に属する費用のおおよその割合は前事業年度54%、当事業年度55%であります。
販売費及び一般管理費のうち主要な費目及び金額は次の通りであります。
| 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | |
| 役員報酬 | 77,551千円 | 85,713千円 |
| 給与手当 | 53,404 | 71,501 |
| 研究開発費 | 140,899 | 232,458 |
| 業務委託費 | 40,600 | 46,704 |
| 特許関連費 | 104,216 | 67,817 |
※3.一般管理費に含まれる研究開発費の総額
| 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | |
| 研究開発費 | 140,899千円 | 232,458千円 |
※4.関係会社との取引に係るものが次の通り含まれております。
| 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | |
| 営業外損益 | ||
| 受取利息 | 422千円 | -千円 |
| 営業外収益「その他」 | 5,432 | - |
※5.抱合せ株式消滅差損
前事業年度(自 平成24年1月1日 至 平成24年12月31日)
当社の連結子会社であったオンコリスダイアグノスティクス株式会社を吸収合併したことによるものであります。
※6.減損損失
当事業年度(自 平成25年1月1日 至 平成25年12月31日)
当事業年度において、当社は以下の通り減損損失を計上いたしました。
① 減損損失を認識した主な資産
| 用途 | 種類 | 場所 |
| 事業用資産 | 機械及び装置 | 兵庫県神戸市 |
② 減損損失の認識に至った経緯
神戸検査センターで保有しております機械及び装置Cyto Trackについては、その後導入した自動顕微鏡システムを用いた検査手法が主流となり、同装置を使用する方式は、現状実用化の見込みが薄く、実際の稼働も殆ど無い為、減損するに至りました。
③ 減損損失の金額
機械及び装置 7,891千円
④ 資産のグルーピングの方法
当社はキャッシュ・フローを生み出す最小単位として、パイプラインを基本単位としてグルーピングしております。
⑤ 回収可能価額の算定方法
回収可能価額の算定に当たっては正味売却価額を用いて計算しており、売却や転用が困難な資産は零としております。
(株主資本等変動計算書関係)
Section titled “(株主資本等変動計算書関係)”前事業年度(自 平成24年1月1日 至 平成24年12月31日)
1.発行済株式の種類及び総数並びに自己株式の種類及び株式数に関する事項
| 当事業年度期首 株式数 (株) | 当事業年度 増加株式数 (株) | 当事業年度 減少株式数 (株) | 当事業年度末 株式数 (株) | |
| 発行済株式 | ||||
| 普通株式(注) | 46,795 | 12,840 | - | 59,635 |
| A種類株式 | 3,636 | - | - | 3,636 |
| 合計 | 50,431 | 12,840 | - | 63,271 |
| 自己株式 | ||||
| 普通株式 | - | - | - | - |
| 合計 | - | - | - | - |
(注)普通株式の発行済株式総数の増加は、新株予約権の行使による増加12,780株、ストック・オプションの権利行使による増加60株であります。
2.新株予約権及び自己新株予約権に関する事項
| 区分 | 新株予約権の内訳 | 新株予約権の目的となる株式の種類 | 新株予約権の目的となる株式の数(株) | 当事業年度末残高 (千円) | |||
| 当事業 年度期首 | 当事業 年度増加 | 当事業 年度減少 | 当事業 年度末 | ||||
| 提出会社 (親会社) | 第9回新株予約権(注) | 普通株式 | 12,780 | - | 12,780 | - | - |
| 第11回新株予約権 | 普通株式 | 1,050 | - | - | 1,050 | - | |
| 合計 | - | 13,830 | - | 12,780 | 1,050 | - | |
(注)第9回新株予約権の当事業年度減少は、新株予約権の行使によるものであります。
3.配当に関する事項
該当事項はありません。
当事業年度(自 平成25年1月1日 至 平成25年12月31日)
1.発行済株式の種類及び総数並びに自己株式の種類及び株式数に関する事項
| 当事業年度期首 株式数 (株) | 当事業年度 増加株式数 (株) | 当事業年度 減少株式数 (株) | 当事業年度末 株式数 (株) | |
| 発行済株式 | ||||
| 普通株式(注)1.2.3.4.5. | 59,635 | 9,017,265 | - | 9,076,900 |
| A種類株式(注)1.2. | 3,636 | 359,964 | 363,600 | - |
| 合計 | 63,271 | 9,377,229 | 363,600 | 9,076,900 |
| 自己株式 | ||||
| 普通株式 | - | - | - | - |
| A種類株式(注)2. | - | 363,600 | 363,600 | - |
| 合計 | - | 363,600 | 363,600 | - |
(注)1. 平成25年3月27日付けで株式1株につき100株の株式分割を実施。この株式分割により、普通株式とA種類株式がそれぞれ5,903,865株と359,964株増加。
2. 平成25年4月9日付けで全てのA種類株式363,600株の取得と引換えに普通株式727,200株を発行。同年4月10日付けで全てのA種類株式363,600株を消却。
3. 平成25年12月5日付でブックビルディングによる募集を実施。普通株式1,820,000株を新規発行。
4. 平成25年12月25日付でオーバーアロットメントによる売出しを実施。普通株式333,000株を新規発行。
5. 平成25年12月にストックオプションの権利行使あり。普通株式233,200株を新規発行。
2.新株予約権及び自己新株予約権に関する事項
| 区分 | 新株予約権の内訳 | 新株予約権の目的となる株式の種類 | 新株予約権の目的となる株式の数(株) | 当事業年度末残高 (千円) | |||
| 当事業 年度期首 | 当事業 年度増加 | 当事業 年度減少 | 当事業 年度末 | ||||
| 提出会社 (親会社) | 第11回新株予約権 (注) | 普通株式 | 1,050 | 103,950 | - | 105,000 | - |
| 合計 | - | 1,050 | 103,950 | - | 105,000 | - | |
(注) 当社は、平成25年3月27日付で株式1株につき100株の株式分割を行っております。これに伴い、新株予約権の目的となる株式の数につきましても、1個当たり1株から100株へ増加しております。
3.配当に関する事項
該当事項はありません。
(キャッシュ・フロー計算書関係)
Section titled “(キャッシュ・フロー計算書関係)”※1 現金及び現金同等物の期末残高と貸借対照表に掲記されている科目の金額との関係
| 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | |
| 現金及び預金勘定 | 696,975千円 | 5,579,610千円 |
| 預入期間が3か月を超える定期預金 | 273,120 | 175,000 |
| 現金及び現金同等物 | 423,855 | 5,404,610 |
2 重要な非資金取引の内容
前事業年度に連結子会社であったオンコリスダイアグノスティクス株式会社の吸収合併に伴い引き継いだ資産及び負債の主な内訳は次の通りです。
| 流動資産 | 18,332千円 |
| 固定資産 | 23,341千円 |
| 資産合計 | 41,674千円 |
| 流動負債 | 106,698千円 |
| 固定負債 | 1,069千円 |
| 負債合計 | 107,768千円 |
(リース取引関係)
Section titled “(リース取引関係)”(借主側)
1.ファイナンス・リース取引
所有権移転外ファイナンス・リース取引
① リース資産の内容
有形固定資産
主として、研究所における製造設備並びに検査設備であります。
② リース資産の減価償却の方法
重要な会計方針「3.固定資産の減価償却の方法」に記載の通りであります。
2.オペレーティング・リース取引
重要性が乏しいため、記載を省略しております。
(金融商品関係)
Section titled “(金融商品関係)”1.金融商品の状況に関する事項
(1)金融商品に対する取組方針
当社は、事業の円滑な遂行のための必要な資金を銀行借入により調達しております。また、資金運用については、短期的な預金等に限定しております。
(2)金融商品の内容及びそのリスク並びに金融商品に係るリスク管理体制
投資有価証券は外国企業の株式であり、市場価格の変動リスク、為替の変動リスクに晒されておりますが、定期的に時価を把握することにより管理を行っております。
営業債務である未払金は1年以内の支払期日です。借入金の使途は、運転資金及び設備投資資金であります。営業債務及び借入金は、流動性リスク(支払期日に支払を実行できなくなるリスク)に晒されておりますが、月次で資金繰計画を作成・更新するなどの方法により管理しております。
2.金融商品の時価等に関する事項
貸借対照表計上額、時価及びこれらの差額については、次の通りです。
前事業年度(平成24年12月31日)
(単位:千円)
| 貸借対照表計上額(*) | 時価(*) | 差額 | |
| (1) 現金及び預金 | 696,975 | 696,975 | - |
| (2) 投資有価証券 | 8,366 | 8,366 | - |
| (3) 短期借入金 | (55,500) | (55,500) | - |
| (4) 未払金 | (10,098) | (10,098) | - |
| (5) 長期借入金(1年内返済予定を含む) | (228,000) | (227,853) | 146 |
(*) 負債に計上されているものについては,( )で示しています。
当事業年度(平成25年12月31日)
(単位:千円)
| 貸借対照表計上額(*) | 時価(*) | 差額 | |
| (1) 現金及び預金 | 5,579,610 | 5,579,610 | - |
| (2) 投資有価証券 | 14,274 | 14,274 | - |
| (3) 短期借入金 | (133,000) | (133,000) | - |
| (4) 未払金 | (36,570) | (36,570) | - |
| (5) 長期借入金(1年内返済予定を含む) | (365,000) | (329,008) | 35,991 |
(*) 負債に計上されているものについては,( )で示しています。
(注) 1. 金融商品の時価の算定方法
(1)現金及び預金、(3)短期借入金、(4)未払金
これらは短期間で決済されるため、時価は帳簿価額にほぼ等しいことから、当該帳簿価額によって
おります。
(2)投資有価証券
投資有価証券は株式であり、時価については取引所の価格によっております。
(5)長期借入金(1年内返済予定を含む)
元利金の合計額を同様の新規借入を行った場合に想定される利率で割り引いて算定する方法によっ
ております。
2. 金銭債権の決算日後の償還予定額
前事業年度(平成24年12月31日)
(単位:千円)
| 1年以内 | 1年超 5年以内 | 5年超 10年以内 | 10年超 | |
| 現金及び預金 | 696,521 | - | - | - |
当事業年度(平成25年12月31日)
(単位:千円)
| 1年以内 | 1年超 5年以内 | 5年超 10年以内 | 10年超 | |
| 現金及び預金 | 5,579,184 | - | - | - |
3.借入金の決算日後の返済予定額
前事業年度(平成24年12月31日)
| 1年以内 (千円) | 1年超 2年以内 (千円) | 2年超 3年以内 (千円) | 3年超 4年以内 (千円) | 4年超 5年以内 (千円) | 5年超 (千円) | |
| 短期借入金 | 55,500 | - | - | - | - | - |
| 長期借入金 | 6,000 | 6,000 | 6,000 | 6,000 | 4,000 | 200,000 |
| 合計 | 61,500 | 6,000 | 6,000 | 6,000 | 4,000 | 200,000 |
当事業年度(平成25年12月31日)
| 1年以内 (千円) | 1年超 2年以内 (千円) | 2年超 3年以内 (千円) | 3年超 4年以内 (千円) | 4年超 5年以内 (千円) | 5年超 (千円) | |
| 短期借入金 | 133,000 | - | - | - | - | - |
| 長期借入金 | 21,672 | 21,672 | 21,656 | - | - | 300,000 |
| 合計 | 154,672 | 21,672 | 21,656 | - | - | 300,000 |
(有価証券関係)
Section titled “(有価証券関係)”1.その他有価証券
前事業年度(平成24年12月31日)
| 種類 | 貸借対照表 計上額(千円) | 取得原価(千円) | 差額(千円) | |
| 貸借対照表計上額が取得原価を超えるもの | (1) 株式 | 8,366 | 8,232 | 134 |
| 合計 | 8,366 | 8,232 | 134 | |
当事業年度(平成25年12月31日)
| 種類 | 貸借対照表 計上額(千円) | 取得原価(千円) | 差額(千円) | |
| 貸借対照表計上額が取得原価を超えるもの | (1) 株式 | 14,274 | 8,232 | 6,041 |
| 合計 | 14,274 | 8,232 | 6,041 | |
2.売却したその他有価証券
前事業年度(自 平成24年1月1日 至 平成24年12月31日)
| 種類 | 売却額(千円) | 売却益の合計額(千円) | 売却損の合計額(千円) |
| (1) 株式 | 4,146 | - | 8,245 |
| 合計 | 4,146 | - | 8,245 |
当事業年度(自 平成25年1月1日 至 平成25年12月31日)
該当事項はありません。
3.減損処理を行った有価証券
前事業年度において、投資有価証券について2,547千円減損処理を行っております。
なお、時価のない株式については、実質価額が著しく低下した場合に減損処理を行っております。
(デリバティブ取引関係)
Section titled “(デリバティブ取引関係)”該当事項はありません。
(退職給付関係)
Section titled “(退職給付関係)”1.採用している退職給付制度の概要
当社は、退職給付制度として退職一時金制度を採用しております。
2.退職給付債務に関する事項
| 前事業年度 (平成24年12月31日) | 当事業年度 (平成25年12月31日) | ||
| (1) 退職給付債務(千円) | 1,585 | 2,115 | |
| (2) 退職給付引当金(千円) | 1,585 | 2,115 | |
(注)退職給付債務の算定に当たっては、簡便法を採用しております。
3.退職給付費用に関する事項
| 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | ||
| (1) 勤務費用(千円) | 817 | 530 | |
| (2) 退職給付費用(千円) | 817 | 530 | |
(注)簡便法を採用しているため、退職給付費用は「勤務費用」として記載しております。
4.退職給付債務等の計算の基礎に関する事項
簡便法を採用しておりますので、基礎率等については記載しておりません。
(ストック・オプション等関係)
Section titled “(ストック・オプション等関係)”1.ストック・オプションに係る費用計上額及び科目名
当社はストック・オプション付与時点において未公開企業であり、付与時点におけるストック・オプション等の単位当たりの本源的価値は0円であるため、費用計上はしておりません。
2.ストック・オプションの内容、規模及びその変動状況
(1)ストック・オプションの内容
| 第1回 新株予約権 | 第10回 新株予約権 | 第12回 新株予約権 | |
| 付与対象者の区分及び人数 | 当社取締役4名 | 当社取締役5名 当社監査役1名 当社従業員12名 社外協力者6名 | 当社取締役7名 当社監査役3名 当社従業員9名 子会社従業員6名 社外協力者3名 |
| 株式の種類別のストック・オプションの数 (注)1 | 普通株式 180,000株 | 普通株式 290,500株 | 普通株式 600,000株 |
| 付与日 | 平成16年5月13日 | 平成22年10月26日 | 平成23年12月6日 |
| 権利確定条件 | (注)2 | (注)2 | (注)2 |
| 対象勤務期間 | 定めておりません | 同左 | 同左 |
| 権利行使期間 | 平成18年6月1日 ~ 平成26年4月30日 | 平成24年11月1日 ~ 平成32年10月26日 | 平成25年12月7日 ~ 平成33年12月6日 |
(注)1. 平成25年3月27日付株式分割(1株につき100株)による分割後の株式数に換算して記載しております。
2. 権利行使時においても、当社の取締役、執行役員、従業員又は監査役、並びに当社の顧問、開発アドバイザー、社外協力者、コンサルタントの地位にあることを要します。但し、任期満了による退任、定年退職その他、正当な理由がある場合はこの限りではありません。
(2)ストック・オプションの規模及びその変動状況
当事業年度(平成25年12月期)において存在するストック・オプションを対象とし、ストック・オプションの数については、株式数に換算して記載しております。
①ストック・オプションの数
| 第1回新株予約権 | 第10回新株予約権 | 第12回新株予約権 | ||
| 権利確定前 | (株) | |||
| 前事業年度末 | - | - | 594,000 | |
| 付与 | - | - | - | |
| 失効 | - | - | 3,000 | |
| 権利確定 | - | - | 591,000 | |
| 未確定残 | - | - | - | |
| 権利確定後 | (株) | |||
| 前事業年度末 | 100,000 | 275,000 | - | |
| 権利確定 | - | - | 591,000 | |
| 権利行使 | 100,000 | 75,300 | 57,900 | |
| 失効 | - | - | - | |
| 未行使残 | - | 199,700 | 533,100 |
(注)平成25年3月27日付株式分割(1株につき100株)による分割後の株式数に換算して記載しております。
②単価情報
| 第1回新株予約権 | 第10回新株予約権 | 第12回新株予約権 | ||
| 権利行使価格 | (円) | 100 | 200 | 1,000 |
| 行使時平均株価 | (円) | 2,985 | 2,958 | 3,064 |
| 付与日における 公正な評価単価 | (円) | - | - | - |
(注)平成25年3月27日付株式分割(1株につき100株)による分割後の株式数に換算して記載しております。
3.ストック・オプションの公正な評価単価の見積方法
ストック・オプションの付与日時点において、当社は株式を証券取引所に上場していないことから、ストック・オプションの公正な評価単価の見積方法を単位当たりの本源的価値の見積りによっております。
また、単位当たりの本源的価値の見積方法は、当社株式の評価額から権利行使価格を控除する方法で算定しており、当社株式の評価方法は、DCF法、取引事例比準法等の中から、それぞれの評価時点において最適と考えられる技法を用いております。
4.ストック・オプションの権利確定数の見積方法
基本的には、将来の失効数の合理的な見積もりは困難であるため、実績の失効数のみ反映させる方法を採用しております。
5.ストック・オプションの単位当たりの本源的価値により算定を行う場合の当事業年度末における本源的価値の合計額及び当事業年度において権利行使されたストック・オプションの権利行使日における本源的価値の合計額
(1)当事業年度末における本源的価値の合計額 1,775,584千円
(2)当事業年度において権利行使されたストック・オプションの権利行使日における本源的価値の合計額
615,696千円
(税効果会計関係)
Section titled “(税効果会計関係)”1.繰延税金資産及び繰延税金負債の発生の主な原因別の内訳
| 前事業年度 (平成24年12月31日) | 当事業年度 (平成25年12月31日) | ||
| 繰延税金資産 | |||
| 製品 | 10,796千円 | 10,122千円 | |
| 未払事業税 | 2,240 | 6,044 | |
| 税務上の繰越欠損金 | 1,399,805 | 1,356,019 | |
| 減価償却超過額 | 90,758 | 99,393 | |
| 税務上の繰延資産 | 2,638 | 1,758 | |
| 資産除去債務 | 2,130 | 2,164 | |
| 退職給付引当金 | 564 | 753 | |
| その他 | 240 | 347 | |
| 繰延税金資産小計 | 1,509,173 | 1,476,606 | |
| 評価性引当額 | △1,509,173 | △1,476,606 | |
| 繰延税金資産合計 | - | - | |
| 繰延税金負債 | |||
| 資産除去債務 | △1,339 | △1,199 | |
| その他有価証券評価差額金 | △47 | △2,153 | |
| 繰延税金負債合計 | △1,386 | △3,352 | |
| 繰延税金負債の純額 | △1,386 | △3,352 |
2.法定実効税率と税効果会計適用後の法人税等の負担率との差異の原因となった主な項目別内訳
税引前当期純損失のため、記載を省略しております。
(持分法損益等)
Section titled “(持分法損益等)”該当事項はありません。
(企業結合等関係)
Section titled “(企業結合等関係)”該当事項はありません。
(資産除去債務関係)
Section titled “(資産除去債務関係)”資産除去債務のうち貸借対照表に計上しているもの
イ 当該資産除去債務の概要
神戸研究所の不動産賃貸借契約に伴う原状回復義務等であります。
ロ 当該資産除去債務の金額の算定方法
使用見込期間を取得から15年と見積り、割引率は1.589%を使用して資産除去債務の算定をしております。
ハ 当事業年度における当該資産除去債務の総額の増減
| 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | |
| 期首残高 | 5,885千円 | 5,979千円 |
| 時の経過による調整額 | 93 | 95 |
| 期末残高 | 5,979 | 6,074 |
(セグメント情報等)
Section titled “(セグメント情報等)”【セグメント情報】
1.報告セグメントの概要
当社の報告セグメントは、当社の構成単位のうち分離された財務情報が入手可能であり、取締役会が、経営資源の配分の決定及び業績を評価するために、定期的に検討を行う対象となっているものであります。
当社は、取り扱う製品・サービスの観点から事業を区分し、各事業部門が包括的な戦略を立案し、事業活動を展開しております。
したがって、当社は、事業別のセグメントから構成されており、「医薬品事業」、「検査薬事業」の2つを報告セグメントとしております。
「医薬品事業」は、医薬品の研究・開発・製造・販売等であります。「検査薬事業」は、検査薬・機器の研究・開発・製造・販売ならびに検査サービスの提供等であります。
2.報告セグメントごとの売上高、利益又は損失、資産、負債その他の項目の金額の算定方法
報告されている事業セグメントの会計処理の方法は、「重要な会計方針」における記載と概ね同一であります。
報告セグメントの利益は、営業利益ベースの数値であります。
資産については、事業セグメントに配分しておりません。
3.報告セグメントごとの売上高、利益又は損失、資産、負債その他の項目の金額に関する情報
前事業年度(自 平成24年1月1日 至 平成24年12月31日)
| (単位:千円) | |||||
| 報告セグメント | 調整額 (注)1 | 財務諸表 計上額(注)2 | |||
| 医薬品事業 | 検査薬事業 | 計 | |||
| 売上高 | |||||
| 外部顧客への売上高 | 394,850 | 1,904 | 396,754 | - | 396,754 |
| セグメント間の内部売上高又は振替高 | - | - | - | - | - |
| 計 | 394,850 | 1,904 | 396,754 | - | 396,754 |
| セグメント利益又は損失(△) | 262,610 | △131,256 | 131,353 | △272,308 | △140,954 |
| その他の項目 | |||||
| 減価償却費 | - | 14,993 | 14,993 | 1,960 | 16,953 |
(注)1. セグメント利益又は損失(△)の調整額△272,308千円は、各報告セグメントに配分していない全社費用であり、主に報告セグメントに帰属しない当社の管理部門に係る経費であります。
2. セグメント利益又は損失(△)は、損益計算書の営業損失と調整を行っております。
当事業年度(自 平成25年1月1日 至 平成25年12月31日)
| (単位:千円) | |||||
| 報告セグメント | 調整額 (注)1 | 財務諸表 計上額(注)2 | |||
| 医薬品事業 | 検査薬事業 | 計 | |||
| 売上高 | |||||
| 外部顧客への売上高 | - | 1,180 | 1,180 | - | 1,180 |
| セグメント間の内部売上高又は振替高 | - | - | - | - | - |
| 計 | - | 1,180 | 1,180 | - | 1,180 |
| セグメント損失(△) | △154,215 | △160,052 | △314,268 | △351,194 | △665,462 |
| その他の項目 | |||||
| 減価償却費 | - | 14,947 | 14,947 | 2,192 | 17,139 |
(注)1. セグメント損失(△)の調整額△351,194千円は、各報告セグメントに配分していない全社費用であり、主に報告セグメントに帰属しない当社の管理部門に係る経費であります。
2. セグメント損失(△)は、損益計算書の営業損失と調整を行っております。
【関連情報】
前事業年度(自平成24年1月1日 至平成24年12月31日)
1.製品及びサービスごとの情報
製品及びサービスの区分が報告セグメント区分と同一であるため、記載を省略しております。
2.地域ごとの情報
(1)売上高
| (単位:千円) | ||||
| 日本 | 米国 | 合計 | ||
| 1,904 | 394,850 | 396,754 | ||
(注) 売上高は顧客の所在地を基礎とし、国又は地域に分類しております。
(2)有形固定資産
本邦以外に所在している有形固定資産がないため該当事項はありません。
3.主要な顧客ごとの情報
| (単位:千円) | ||
| 顧客の名称又は氏名 | 売上高 | 関連するセグメント名 |
| Bristol-Myers Squibb Co. | 394,850 | 医薬品事業 |
当事業年度(自平成25年1月1日 至平成25年12月31日)
1.製品及びサービスごとの情報
製品及びサービスの区分が報告セグメント区分と同一であるため、記載を省略しております。
2.地域ごとの情報
(1)売上高
| (単位:千円) | ||||
| 日本 | 韓国 | 合計 | ||
| 180 | 1,000 | 1,180 | ||
(注) 売上高は顧客の所在地を基礎とし、国又は地域に分類しております。
(2)有形固定資産
本邦以外に所在している有形固定資産がないため該当事項はありません。
3.主要な顧客ごとの情報
| (単位:千円) | ||
| 顧客の名称又は氏名 | 売上高 | 関連するセグメント名 |
| WONIK CUBE Corp. | 1,000 | 検査薬事業 |
| 独立行政法人国立病院機構 呉医療センター中国がんセンター | 180 | 検査薬事業 |
【報告セグメントごとの固定資産の減損損失に関する情報】
前事業年度(自平成24年1月1日 至平成24年12月31日)
該当事項はありません。
当事業年度(自平成25年1月1日 至平成25年12月31日)
| 医薬品事業 | 検査薬事業 | 調整額 | 合計 | |
| 減損損失 | - | 7,891 | - | 7,891 |
【報告セグメントごとののれんの償却額及び未償却残高に関する情報】
該当事項はありません。
【報告セグメントごとの負ののれん発生益に関する情報】
該当事項はありません。
【関連当事者情報】
Section titled “【関連当事者情報】”1.子会社及び関連会社等
前事業年度(自 平成24年1月1日 至 平成24年12月31日)
| 種類 | 会社等の名称又は氏名 | 所在地 | 資本金 又は 出資金 (千円) | 事業の内容又は職業 | 議決権等 の所有 (被所有) 割合(%) | 関連当事者との関係 | 取引の 内容 | 取引 金額 (千円) | 科目 | 期末 残高 (千円) |
| 子会社 | オンコリスダイアグノスティクス株式会社(注)3 | 東京都港区 | 1,000 | 検査試薬・機器の研究・開発・製造・販売ならびに検査サービスの提供等 | 所有 直接 100.0 | 資金の援助・役員の兼任・ライセンス契約締結先 | 資金の貸付 (注)2 利息の受取 (注)2 管理業務の受託 (注)2 建物の賃貸(注)2 | 11,000 422 2,250 3,182 | - - - - | - - - - |
取引条件及び取引条件の決定方針
(注)1.取引金額には消費税等を含めておりません。
2.価格その他の取引条件については、市場価格等を参考に決定しております。
3.オンコリスダイアグノスティクス株式会社は、平成24年4月1日に当社に吸収合併されておりますので、合併期日までの期間の同社との取引金額を記載しております。
当事業年度(自 平成25年1月1日 至 平成25年12月31日)
該当事項はありません。
2.役員及び個人主要株主等
前事業年度(自 平成24年1月1日 至 平成24年12月31日)
| 種類 | 会社等の名称又は氏名 | 所在地 | 資本金又は 出資金 (千円) | 事業の内容又は職業 | 議決権等 の所有 (被所有) 割合(%) | 関連当事者との関係 | 取引の 内容 | 取引 金額 (千円) | 科目 | 期末 残高 (千円) |
| 役員 | 浦田 泰生 | - | - | 当社代表 取締役社長 | (被所有) 直接4.20 | - | 借入金に係る被債務保証 | 73,500 | - | - |
取引条件及び取引条件の決定方針
(注)1.当社の銀行借入に対するものであり、「取引金額」は平成24年12月末残高であります。なお、債務被保証に
対しての保証料は支払っておりません。
2.当該債務保証については、平成25年8月末日に解消しております。
当事業年度(自 平成25年1月1日 至 平成25年12月31日)
| 種類 | 会社等の名称又は氏名 | 所在地 | 資本金又は 出資金 (千円) | 事業の内容又は職業 | 議決権等 の所有 (被所有) 割合(%) | 関連当事者との関係 | 取引の 内容 | 取引 金額 (千円) | 科目 | 期末 残高 (千円) |
| 役員 | 浦田 泰生 | - | - | 当社代表 取締役社長 | (被所有) 直接3.53 | - | ストックオプションの権利行使 | 12,000 | - | - |
| 六反田 靖 | - | - | 当社取締役 | (被所有) 直接0.94 | - | ストックオプションの権利行使 | 12,000 | - | - | |
| 樫原 康成 | - | - | 当社取締役 | (被所有) 直接0.85 | - | ストックオプションの権利行使 | 12,000 | - | - |
(1株当たり情報)
Section titled “(1株当たり情報)”| 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | |
| 1株当たり純資産額 | 74.67円 | 561.17円 |
| 1株当たり当期純損失金額(△) | △16.83円 | △94.33円 |
(注)1. 潜在株式調整後1株当たり当期純利益金額については、潜在株式は存在するものの、1株当たり当期純損失金額であるため記載しておりません。
2. 当社は、平成25年3月27日付で株式1株につき100株の株式分割を行っております。前事業年度の期首に当該株式分割が行われたと仮定して1株当たり純資産額及び1株当たり当期純損失金額を算定しております。
3. 1株当たり当期純損失金額の算定上の基礎は、以下の通りであります。
| 前事業年度 (自 平成24年1月1日 至 平成24年12月31日) | 当事業年度 (自 平成25年1月1日 至 平成25年12月31日) | |
| 1株当たり当期純損失金額 | ||
| 当期純損失(△)(千円) | △102,829 | △635,553 |
| 普通株主に帰属しない金額(千円) | - | - |
| 普通株式に係る当期純損失(△)(千円) | △102,829 | △635,553 |
| 期中平均株式数(株) | 6,108,182 | 6,737,371 |
| (うち普通株式) | (5,744,582) | (6,737,371) |
| (うちA種類株式) | (363,600) | (98,620) |
(重要な後発事象)
Section titled “(重要な後発事象)”該当事項はありません。
⑥【附属明細表】
Section titled “⑥【附属明細表】”【有価証券明細表】
Section titled “【有価証券明細表】”【株式】
| 投資有価証券 | その他有価証券 | 銘柄 | 株式数(株) | 貸借対照表計上額 (千円) |
| Benitec Biopharma,Ltd. | 266,270 | 14,274 | ||
| 小計 | 266,270 | 14,274 | ||
| 計 | 266,270 | 14,274 | ||
【有形固定資産等明細表】
Section titled “【有形固定資産等明細表】”| 資産の種類 | 当期首残高 (千円) | 当期増加額 (千円) | 当期減少額 (千円) | 当期末残高 (千円) | 当期末減価償却累計額又は償却累計額 (千円) | 当期償却額 (千円) | 差引当期末残高 (千円) |
| 有形固定資産 | |||||||
| 建物 | 22,104 | - | - | 22,104 | 11,916 | 1,559 | 10,187 |
| 機械及び装置 | 37,761 | - | 7,891 (7,891) | 29,870 | 29,870 | 3,595 | - |
| 工具、器具及び備品 | 58,409 | 14,878 | 1,683 | 71,603 | 45,939 | 11,481 | 25,664 |
| 有形固定資産計 | 118,275 | 14,878 | 9,575 | 123,578 | 87,726 | 16,636 | 35,852 |
| 無形固定資産 | |||||||
| ソフトウエア | 2,040 | - | - | 2,040 | 779 | 408 | 1,261 |
| 無形固定資産計 | 2,040 | - | - | 2,040 | 779 | 408 | 1,261 |
(注)当期増加額及び当期減少額のうち主なものは次のとおりであります。
1. 工具、器具及び備品の当期増加額のうち、主なものは、神戸検査センターの電動倒立顕微鏡14,200千円です。
2. 工具、器具及び備品の当期減少額のうち、主なものは、本社のサイボーズサーバ除却1,683千円です。
3. 「当期減少額」欄の( )内は内書きで、減損損失の計上額です。
【社債明細表】
Section titled “【社債明細表】”該当事項はありません。
【借入金等明細表】
Section titled “【借入金等明細表】”| 区分 | 当期首残高 (千円) | 当期末残高 (千円) | 平均利率 (%) | 返済期限 |
| 短期借入金 | 61,500 | 133,000 | 1.75 | - |
| 1年以内に返済予定の長期借入金 | - | 21,672 | 2.00 | - |
| 1年以内に返済予定のリース債務 | 2,160 | 5,055 | 3.00 | - |
| 長期借入金(1年以内に返済予定のものを除く。) | 222,000 | 343,328 | 0.40 | 平成28年11月~ 平成38年8月 |
| リース債務(1年以内に返済予定のものを除く。) | 6,218 | 15,194 | 2.97 | 平成27年12月~ 平成30年8月 |
| 合計 | 291,878 | 518,249 | - | - |
(注)1.「平均利率」については、借人金等の期末残高に対する加重平均利率を記載しております。
2.長期借入金のうち日本政策金融公庫からの借入については、償却前売上高経常利益率の成功判定区分に応じて利率を決定しております。
3.長期借入金及びリース債務(1年以内に返済予定のものを除く。)の決算日後5年間の返済予定額は以下のとおりであります。
| 1年超2年以内(千円) | 2年超3年以内(千円) | 3年超4年以内(千円) | 4年超5年以内(千円) | ||
| 長期借入金 | 21,672 | 21,656 | - | - | |
| リース債務 | 4,896 | 4,837 | 3,341 | 2,118 |
【引当金明細表】
Section titled “【引当金明細表】”| 区分 | 当期首残高 (千円) | 当期増加額 (千円) | 当期減少額 (目的使用) (千円) | 当期減少額 (その他) (千円) | 当期末残高 (千円) |
| 退職給付引当金 | 1,585 | 530 | - | - | 2,115 |
【資産除去債務明細表】
Section titled “【資産除去債務明細表】”| 区分 | 当期首残高 (千円) | 当期増加額 (千円) | 当期減少額 (千円) | 当期末残高 (千円) |
| 不動産賃貸借契約に伴う現状回復義務 | 5,979 | 95 | - | 6,074 |
(2)【主な資産及び負債の内容】
Section titled “(2)【主な資産及び負債の内容】”① 流動資産
イ.現金及び預金
| 区分 | 金額(千円) |
| 現金 | 426 |
| 預金 | |
| 普通預金 | 5,284,650 |
| 外貨普通預金 | 119,534 |
| 定期預金 | 175,000 |
| 小計 | 5,579,184 |
| 合計 | 5,579,610 |
ロ.売掛金
相手先別内訳
| 相手先 | 金額(千円) |
| WONIK CUBE Corp. | 1,000 |
| 合計 | 1,000 |
売掛金の発生及び回収並びに滞留状況
| 当期首残高 (千円) | 当期発生高 (千円) | 当期回収高 (千円) | 当期末残高 (千円) | 回収率(%) | 滞留日数(日) |
| - | 1,180 | 180 | 1,000 | 15.3 | 155 |
ハ.製品
| 品目 | 金額(千円) |
| 製品 | |
| ウイルス製剤(OBP301) | 12,600 |
| ウイルス製剤(OBP401) | 2,284 |
| ウイルス製剤(OBP1101) | 4,639 |
| 合計 | 19,523 |
ニ.貯蔵品
| 品目 | 金額(千円) |
| 貯蔵品 | |
| 研究用消耗品 | 1,964 |
| その他 | 126 |
| 合計 | 2,090 |
(3)【その他】
Section titled “(3)【その他】”当事業年度における四半期情報等
| (累計期間) | 第1四半期 | 第2四半期 | 第3四半期 | 当事業年度 |
| 売上高(千円) | - | - | 40 | 1,180 |
| 税引前四半期(当期)純損失金額(△)(千円) | - | - | △340,089 | △633,193 |
| 四半期(当期)純損失金額(△)(千円) | - | - | △341,628 | △635,553 |
| 1株当たり四半期(当期)純損失金額(△)(円) | - | - | △52.07 | △94.33 |
| (会計期間) | 第1四半期 | 第2四半期 | 第3四半期 | 第4四半期 |
| 1株当たり四半期純損失金額(△)(円) | - | - | △17.70 | △40.71 |
(注)1.当社は、平成25年12月6日付で東京証券取引所マザーズに上場いたしましたので、当事業年度の四半期報告書は提出しておりませんが、金融商品取引法第193条の2第1項の規定に基づき、当第3四半期会計期間及び当第3四半期累計期間の四半期財務諸表について、新日本有限責任監査法人により四半期レビューを受けております。
2.当社は、平成25年3月27日付で株式1株につき100株の株式分割を行っております。当事業年度の期首に当該株式分割が行われたと仮定して1株当たり四半期(当期)純損失金額を算定しております。
第6【提出会社の株式事務の概要】
Section titled “第6【提出会社の株式事務の概要】”| 事業年度 | 1月1日から12月31日まで |
| 定時株主総会 | 事業年度終了後3ヶ月以内 |
| 基準日 | 12月31日 |
| 剰余金の配当の基準日 | 6月30日 12月31日 |
| 1単元の株式数 | 100株 |
| 単元未満株式の買取り | |
| 取扱場所 | (特別口座)東京都千代田区丸の内一丁目4番1号 三井住友信託銀行株式会社 証券代行部 |
| 株主名簿管理人 | (特別口座)東京都千代田区丸の内一丁目4番1号 三井住友信託銀行株式会社 |
| 取次所 | - |
| 買取手数料 | 株式の売買の委託に係る手数料相当額として別途定める金額 |
| 公告掲載方法 | 電子公告により行う。 ただし、電子公告によることができない事故その他やむを得ない事由が 生じたときは、日本経済新聞に掲載して行う。 公告掲載URL http://www.oncolys.com/jp/ir/ir.html |
| 株主に対する特典 | 該当事項はありません。 |
(注) 当会社の株主は、その有する単元未満株式について、次に掲げる権利以外の権利を行使することができない旨、定款に定めています。
(1)会社法第189条第2項各号に掲げる権利
(2)会社法第166条第1項の規定による請求をする権利
(3)株主の有する株式数に応じて募集株式の割当て及び募集新株予約権の割当てを受ける権利
第7【提出会社の参考情報】
Section titled “第7【提出会社の参考情報】”1【提出会社の親会社等の情報】
Section titled “1【提出会社の親会社等の情報】”当社は、金融商品取引法第24条の7第1項に規定する親会社等はありません。
2【その他の参考情報】
Section titled “2【その他の参考情報】”当事業年度の開始日から有価証券報告書提出日までの間に、次の書類を提出しております。
(1)有価証券届出書(有償一般募集増資及び売出し)及びその添付書類
平成25年10月31日関東財務局長に提出。
(2)有価証券届出書の訂正届出書
平成25年11月20日及び平成25年11月28日関東財務局長に提出。
平成25年10月31日提出の有価証券届出書に係る訂正届出書であります。
(3)臨時報告書
平成25年12月12日関東財務局長に提出。
企業内容等の開示に関する内閣府令第19条第2項第4号に基づく臨時報告書であります。
第二部【提出会社の保証会社等の情報】
Section titled “第二部【提出会社の保証会社等の情報】”該当事項はありません。
| 独立監査人の監査報告書及び内部統制監査報告書 |
| 平成26年3月26日 | |||
| オンコリスバイオファーマ株式会社 | |||
| 取締役会 御中 | |||
| 新日本有限責任監査法人 |
| 指定有限責任社員 業務執行社員 | 公認会計士 | 稲垣 正人 印 |
| 指定有限責任社員 業務執行社員 | 公認会計士 | 上林 礼子 印 |
<財務諸表監査>
当監査法人は、金融商品取引法第193条の2第1項の規定に基づく監査証明を行うため、「経理の状況」に掲げられているオンコリスバイオファーマ株式会社の平成25年1月1日から平成25年12月31日までの第10期事業年度の財務諸表、すなわち、貸借対照表、損益計算書、株主資本等変動計算書、キャッシュ・フロー計算書、重要な会計方針、その他の注記及び附属明細表について監査を行った。
財務諸表に対する経営者の責任
経営者の責任は、我が国において一般に公正妥当と認められる企業会計の基準に準拠して財務諸表を作成し適正に表示することにある。これには、不正又は誤謬による重要な虚偽表示のない財務諸表を作成し適正に表示するために経営者が必要と判断した内部統制を整備及び運用することが含まれる。
監査人の責任
当監査法人の責任は、当監査法人が実施した監査に基づいて、独立の立場から財務諸表に対する意見を表明することにある。当監査法人は、我が国において一般に公正妥当と認められる監査の基準に準拠して監査を行った。監査の基準は、当監査法人に財務諸表に重要な虚偽表示がないかどうかについて合理的な保証を得るために、監査計画を策定し、これに基づき監査を実施することを求めている。
監査においては、財務諸表の金額及び開示について監査証拠を入手するための手続が実施される。監査手続は、当監査法人の判断により、不正又は誤謬による財務諸表の重要な虚偽表示のリスクの評価に基づいて選択及び適用される。財務諸表監査の目的は、内部統制の有効性について意見表明するためのものではないが、当監査法人は、リスク評価の実施に際して、状況に応じた適切な監査手続を立案するために、財務諸表の作成と適正な表示に関連する内部統制を検討する。また、監査には、経営者が採用した会計方針及びその適用方法並びに経営者によって行われた見積りの評価も含め全体としての財務諸表の表示を検討することが含まれる。
当監査法人は、意見表明の基礎となる十分かつ適切な監査証拠を入手したと判断している。
監査意見
当監査法人は、上記の財務諸表が、我が国において一般に公正妥当と認められる企業会計の基準に準拠して、オンコリスバイオファーマ株式会社の平成25年12月31日現在の財政状態並びに同日をもって終了する事業年度の経営成績及びキャッシュ・フローの状況をすべての重要な点において適正に表示しているものと認める。
<内部統制監査>
当監査法人は、金融商品取引法第193条の2第2項の規定に基づく監査証明を行うため、オンコリスバイオファーマ株式会社の平成25年12月31日現在の内部統制報告書について監査を行った。
内部統制報告書に対する経営者の責任
経営者の責任は、財務報告に係る内部統制を整備及び運用し、我が国において一般に公正妥当と認められる財務報告に係る内部統制の評価の基準に準拠して内部統制報告書を作成し適正に表示することにある。
なお、財務報告に係る内部統制により財務報告の虚偽の記載を完全には防止又は発見することができない可能性がある。
監査人の責任
当監査法人の責任は、当監査法人が実施した内部統制監査に基づいて、独立の立場から内部統制報告書に対する意見を表明することにある。当監査法人は、我が国において一般に公正妥当と認められる財務報告に係る内部統制の監査の基準に準拠して内部統制監査を行った。財務報告に係る内部統制の監査の基準は、当監査法人に内部統制報告書に重要な虚偽表示がないかどうかについて合理的な保証を得るために、監査計画を策定し、これに基づき内部統制監査を実施することを求めている。
内部統制監査においては、内部統制報告書における財務報告に係る内部統制の評価結果について監査証拠を入手するための手続が実施される。内部統制監査の監査手続は、当監査法人の判断により、財務報告の信頼性に及ぼす影響の重要性に基づいて選択及び適用される。また、内部統制監査には、財務報告に係る内部統制の評価範囲、評価手続及び評価結果について経営者が行った記載を含め、全体としての内部統制報告書の表示を検討することが含まれる。
当監査法人は、意見表明の基礎となる十分かつ適切な監査証拠を入手したと判断している。
監査意見
当監査法人は、オンコリスバイオファーマ株式会社が平成25年12月31日現在の財務報告に係る内部統制は有効であると表示した上記の内部統制報告書が、我が国において一般に公正妥当と認められる財務報告に係る内部統制の評価の基準に準拠して、財務報告に係る内部統制の評価結果について、すべての重要な点において適正に表示しているものと認める。
利害関係
会社と当監査法人又は業務執行社員との間には、公認会計士法の規定により記載すべき利害関係はない。
以 上
| (注)1.上記は、監査報告書の原本に記載された事項を電子化したものであり、その原本は当社が別途保管しております。 2.XBRLデータは監査の対象に含まれておりません。 |